
| A、0.05 mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.10 mol?L-1 |
| D、0.50 mol?L-1 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、铜和锌 | B、镁和铜 |
| C、铝和镁 | D、锌和铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
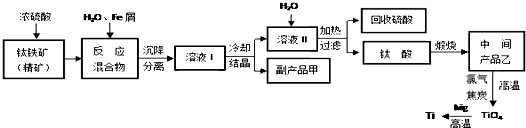
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正反应方向移动 |
| B、a<c+d |
| C、D的体积分数变大 |
| D、A的转化率变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、奶制品的非法添加物三聚氰胺(市场上称“蛋白精”)是一种有毒蛋白质 |
| B、我们所吃的豆腐中主要含有葡萄糖 |
| C、棉花和蚕丝的主要成分都是纤维素 |
| D、用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(CH3)2CHCH2CH2CH3 |
| B、(CH3CH2)2CHCH3 |
| C、(CH3)3CCH2CH3 |
| D、(CH3)2CHCH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KClO3是氧化剂 |
| B、HCl是还原剂 |
| C、H2O既不是氧化产物也不是还原产物 |
| D、KCl既是还原产物也是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2分子的结构按VSEPR模型是V型 |
| B、分子CO和N2的原子总数相同,价电子总数相等,故性质相似 |
| C、Na+的电子排布式为1s22s22p63s1 |
| D、有机物CH2=CH-CH3中杂化类型有sp3 和sp2,其中有两个π键,7个σ键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com