
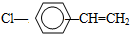
 ,该有机物能发生( )
,该有机物能发生( )| A. | 只有③⑥不能发生 | B. | 只有⑥不能发生 | ||
| C. | 只有①不能发生 | D. | 以上反应均可发生 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体 | |
| B. | 纤维素水解的最终产物能发生银镜反应 | |
| C. | 蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 | |
| D. | 脂肪发生皂化反应,生成甘油和高级脂肪酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷表现出一定的金属性 | B. | 砷在通常情况下是固体 | ||
| C. | 砷酸H3AsO4是一种氧化性强酸 | D. | 砷难与H2化合,砷化氢极不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol | B. | 10mol | C. | 7.5mol | D. | 6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融Al2O3制金属铝,用铁作阳极 | |
| B. | 电解法精炼粗铜,用纯铜作阴极 | |
| C. | 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 | |
| D. | 在镀件上镀锌,用锌用阳极,硫酸锌作电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结 论 |
| A | 将盐酸滴入Na2CO3溶液中 | 有气泡产生 | 盐酸的酸性强于碳酸,故;氯的非金属性比碳强 |
| B | 在0.1mol•L-1的NaHCO3溶液中加2滴酚酞,微热 | 溶液颜色由浅红色逐渐加深 | 盐类的水解反应是吸热反应 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 氨气呈碱性 |
| D | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com