
(06年上海化学26)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如下图装置。倾斜A使稀硫酸(足量)与固体 M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为V mL(已折算成标准状况)由上述实验事实可知:?
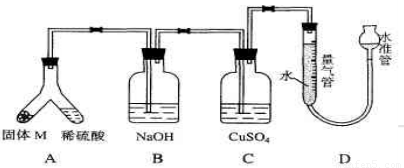
(1)①固体M中一定有的物质是_____(填化学式)理由是_____。②其中一种物质的质量可以确定为____g(用代数式表示)。?
(2)B装置的名称是_____。写出B装置中反应的离子方程式_____。?
(3)C装置的作用是_____,如果实验中没有B装置,则C装置中产生的现象是__________ 。?
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____ 。?
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是__________
a.M中有未反应的铁和硫?
b.测定气体体积时水准管的水面高于量气管的水面?
c.A中留有反应生成的气体?
d.气体进入D装置前未用浓硫酸干燥
(1)①FeS、Fe B装置增重、量气管有气体。② V/400
(2)洗气瓶 2OH-+H2S → 2H2O+S2--
(3)证明H2S已被完全吸收 黑色沉淀
(4)硫 漏斗、玻璃棒 (5) b、C。
【解析】
试题分析:(1)①B装置增重,说明反应中一定H2S气体生成,因此一定含有FeS;量气管有气体,说明反应中有氢气生成,因此还含有铁,所以M中一定有的物质是FeS、Fe;
②最后收集到的气体体积是Vml,因此氢气的物质的量就是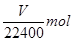 ,则铁的物质的量也是
,则铁的物质的量也是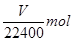 ,器质量就是
,器质量就是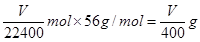 。
。
(2)从整个装置的设计来分析,实验的流程是让混合气体先通过B洗气瓶除去H2S,然后再通过CuSO4溶液检验H2S是否除净,所以B装置的名称是洗气瓶,其中反应的离子方程式为:2OH-+H2S 2H2O+S2-;
2H2O+S2-;
(3)C装置的作用是证明H2S已被完全吸收,如果实验中没有B装置,则C装置中将产生CuS黑色沉淀;
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,则该固体一定是S,单质S不溶于水,所以分离该固体,应采用过滤的操作,所需玻璃仪器为烧杯、漏斗和玻璃棒;
(5)如果A中留有气体,导致D中测量的气体减少,从而影响对剩余铁的计算;另外如果测定气体的体积时水面高于量气管,会导致量气管内气体压强增大,使测量的气体体积变小,导致Fe的计算量变小,所以答案选bc。?
考点:考查化学实验基本操作,包括仪器的选择、试剂的选择、实验方案的设计和评价、误差分析等
点评:本题是一道定性和定量相结合的综合实验考题,试题借助Fe和S反应的产物与硫酸发生反应,根据实验现象进行问题设计,综合考查学生的实验探究能力。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com