
分析 结合n=$\frac{V}{Vm}$、n=$\frac{m}{M}$及Cl2+2NaOH=NaCl+NaClO+H2O计算.
解答 解:氯气的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
NaOH的物质的量为$\frac{10g}{40g/mol}$=0.25mol,
由Cl2+2NaOH=NaCl+NaClO+H2O可知,氯气完全反应,NaOH剩余,
则生成NaClO的物质的量是0.1mol,
答:生成NaClO的物质的量是0.1mol.
点评 本题考查物质的量的计算,为高频考点,把握质量、体积、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意发生的反应及过量判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化氮和一氧化氮 | B. | 氢气和氧气 | ||
| C. | 氧气和二氧化氮 | D. | 氯气和氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的N2和CO所含分子数均为NA | |
| B. | 1.7g H2O2中含有的电子数为0.9 NA | |
| C. | 1mol Na2O2固体中含离子总数为4 NA | |
| D. | 标准状况下,2.24L戊烷所含分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
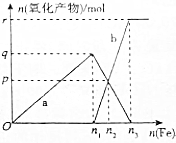 氮及其化合物与人们的生活息息相关,请回答下列有关问题.
氮及其化合物与人们的生活息息相关,请回答下列有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
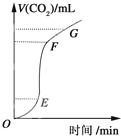
| A. | OE段表示反应速率最快 | |
| B. | EF段表示反应速率最快,收集的CO2最多 | |
| C. | FG段表示收集的CO2最多 | |
| D. | OG段表示随着时间的推移,反应速率逐渐增快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a和b用导线连接时,该装置为原电池,铁片为负极,发生氧化反应 | |
| B. | a和b用导线连接时,Pt片上发生的反应为:Cu2++2e-═Cu | |
| C. | a和b分别连接直流电源正、负极时,该装置为电解池,Pt片为阳极,电极反应式为:4OH--4e-═O2↑+2H2O | |
| D. | a和b分别连接直流电源正、负极时,Cu2+向Pt电极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com