
下列各组物质全部是弱电解质的是( )
|
| A. | H2O、NH3•H2O、H3PO4、HF |
|
| B. | Cu(OH)2、CH3COOH、C2H5OH、CH3COONa |
|
| C. | H2SO3、Ba(OH)2、BaSO4 Fe |
|
| D. | H2SiO3、H2S、CO2 NaCl |
考点:
弱电解质在水溶液中的电离平衡.
专题:
电离平衡与溶液的pH专题.
分析:
在水溶液里或熔融状态下部分电离的电解质是弱电解质,完全电离的电解质是强电解质,弱酸和弱碱、水属于弱电解质,据此分析解答.
解答:
解:A.H2O、NH3•H2O、H3PO4、HF在水溶液都部分电离,都是弱电解质,故A正确;
B.CH3COONa是强电解质,故B错误;
C.Ba(OH)2、BaSO4是强电解质,Fe既不是电解质也不是非电解质,故C错误;
D.NaCl是强电解质,CO2是非电解质,故D错误;
故选A.
点评:
本题考查了强弱电解质的判断,根据电解质的电离程度划分电解质强弱,与电解质的溶解性无关,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
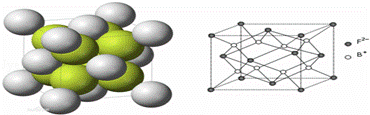
有A、B、D、E、F、G六种前四周期的元素,A是宇宙中最丰富的元素,B和D的原子都有1个未成对电子,B+比D少一个电子层,D原子得一个电子填入3p轨道后,3p轨道全充满;E原子的2p轨道中有3个未成对电子,F的最高化合价和最低化合价的代数和为4.R是由B、F两元素形成的离子化合物,其中B+与F2﹣离子数之比为2:1.G位于周期表第6纵行且是六种元素中原子序数最大的.
请回答下列问题:
(1)D元素的电负性 F元素的电负性(填“>”、“<”或“=”).
(2)G的价电子排布图 .
(3)B形成的晶体堆积方式为 ,空间利用率为 区分晶体和非晶体最可靠的科学方法是对固体进行 实验.
(4)D﹣的最外层共有 种不同运动状态的电子,有 种能量不同的电子.F2D2广泛用于橡胶工业,各原子均满足八电子稳定结构,F2D2中F原子的杂化类型是 ,F2D2是 分子(填“极性”或“非极性”).
(5)A与E形成的最简单化合物分子在水中溶解度很大的原因 .该分子是极性分子的原因 是 .
(6)如图所示是R形成的晶体的晶胞,设该晶体密度是ρ/g•cm﹣3.试计算R晶胞的体积是 (阿伏加德罗常数用NA表示,只写出计算式,不用计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式书写正确的是( )
|
| A. | NaHCO3=Na++H++CO32﹣ | B. | HF⇌H++F﹣ |
|
| C. | H2CO3⇌2H++CO32﹣ | D. | CH3COONH4⇌CH3COO﹣+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于3Fe(s)+4H2O(g)⇌Fe3O4(s)+4H2(g),反应的化学平衡常数的表达式为( )
|
| A. | K= |
|
| B. | K= |
|
| C. | K= |
|
| D. | K= |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是( )


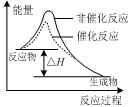
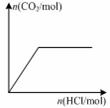
图甲 图乙 图丙 图丁
A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B.图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C.图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D.图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃,NaOH和Na2CO3两溶液的pH均为11。
(1)两溶液中,由水电离出的c(OH-)分别是:
①NaOH溶液中___________________________________________________;
②Na2CO3溶液中__________________________________________________;
③在1 L水中加入上述溶液中的________会使水的电离程度减小。
(2)各取10 mL上述两种溶液,分别加水稀释到100 mL,pH变化较大的是________(填化学式)溶液。
(3)纯碱溶液呈碱性的原因是(用离子方程式表示_____________________。
(4)为探究纯碱溶液呈碱性是由CO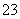 水解引起的,请你设计一个简单的实验方案。
水解引起的,请你设计一个简单的实验方案。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com