
海水是巨大的资源宝库,下列说法正确的是
A.碘元素又称“海洋元素”
B.镁是海水中含量最多的金属元素
C.从海水中提取食盐和碘的过程都是物理变化
D.氯碱工业和纯碱工业的原料都有食盐
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014学年甘肃省张掖市高三第三次诊断考试理综化学试卷(解析版) 题型:填空题
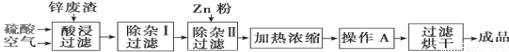
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 8.0 |
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是 。
为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 。
为控制上述PH范围可选择加入的试剂或药品是 。
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)在“除杂Ⅱ”步骤中,加入Zn粉的作用是 。“操作A”的名称是 。
(4)常温下,已知Ksp〔Cu(OH)2〕=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省天门市毕业生四月调研测试理综化学试卷(解析版) 题型:选择题
将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如右
图所示。则下列说法不正确的是
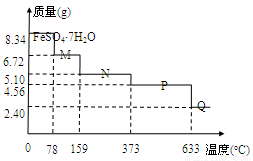
A.在100℃时,M的化学式为FeSO4·4H2O
B.FeSO4·7H2O晶体中有4种不同结合力的水分子
C.FeSO4·H2O存在的最高温度为373℃
D.380℃的P加热至650℃时的化学方程式为:2FeSO4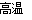 Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省商丘市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4L正丁烷和异丁烷的混合物中所含共用电子对数为14NA
B.常温常压下,15.0g甲醛与葡萄糖的混合物中含有氢原子的数目为NA
C.60g SiO2晶体所含Si—O键的数目为2NA ,78 g苯含有C=C双键的数目为3NA
D.将CO2通过Na2O2使其增重a g时,反应中转移电子数为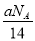
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省唐山市高三4月第二次模拟理综化学试卷(解析版) 题型:选择题
已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-。现有16.8 g铁和0.3 mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2。下列叙述不正确的是
A.当a = 0.1时,发生的反应为2Fe2++Cl2=2Fe3++2Cl-
B.当a = 0.45时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.若溶液中Br-有一半被氧化时, c(Fe3+): c(Br-):c(Cl-) =1:1:3
D.当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+ c(OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省景德镇市高三第一次模拟考试卷理综化学试卷(解析版) 题型:实验题
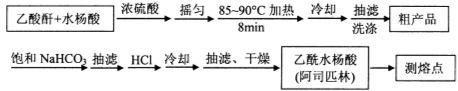
阿司匹林(乙酰水杨酸, )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
主要试剂和产品的物理常数
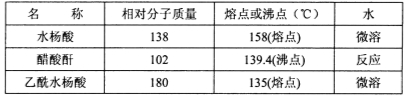
请根据以上信息回答下列问题:
(1)①合成阿斯匹林时,最合适的加热方式是 。
②抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是 。
(2)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤,则加饱和NaHCO3溶液的目的是 。
另一种改进的提纯方法,称为重结晶提纯法。方法如下:
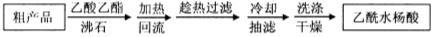
(3)改进的提纯方法中加热回流的装置如图所示,
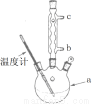
①使用温度计的目的是 。冷凝水的流进方向是 。(填“b”或“c”)。
②重结晶提纯法所得产品的有机杂质要比原方案少的原因 。
(4)检验产品中是否含有水杨酸的化学方法是 。
(5)该学习小组在实验中原料用量:2.0 g水杨酸、5.0 mL醋酸酐(ρ=1.08 g/cm3),最终称得产品m=2.2 g,则所得乙酰水杨酸的产率为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省景德镇市高三第一次模拟考试卷理综化学试卷(解析版) 题型:选择题
某有机化合物,只含碳、氢二种元素,相对分子质量为56,完全燃烧时产生等物质的量的CO2和H2O。它可能的结构共有(需考虑顺反异构)
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:填空题
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3 | Cl- |
浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
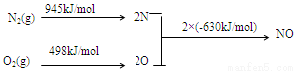
① N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
② 当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
③ 汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现? 。你的依据是 。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
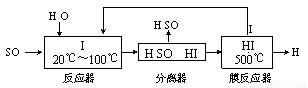
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:填空题
2013年诺贝尔化学奖授予三位美国科学家,以表彰他们在开发多尺度复杂化学系统模型方面所做的贡献。可以用量子化学计算小区间内(如光合作用叶绿体光反应时酶中、生物固氮时固氮酶中)的化学反应。
(1)固氮酶有由铁蛋白和钼铁蛋白两种,它们不仅能够催化N2还原成NH3以外,还能将环境底物乙炔催化还原成乙烯,下列说法正确的有 (不定项选择)。
a.C2H2、C2H4都是非极性分子
b.碳负离子CH3-呈三角锥形
c.NO+电子式为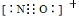

d.NH3沸点比N2高,主要是因为前者是极性分子
(2)钒可合成电池电极也可人工合成的二价钒(V)固氮酶(结构如下图)。
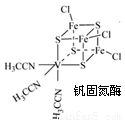
①V2+基态时核外电子排布式为 。
②钒固氮酶钒的配位原子有 (写元素符号)。
③熔融空气电池钒硼晶体晶胞结构如下图所示,该晶胞中含有钒原子数目为 。
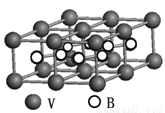
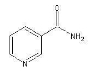
(3)烟酰胺(结构式如图)可用于合成光合辅酶NADPH ,烟酰胺分子中氮原子的杂化轨道类型有 ,1mol该分子中含σ键数目为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com