
 或
或 .
.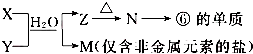
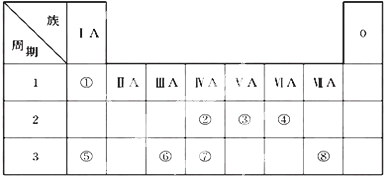
分析 由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)由于同周期自左而右金属性减弱、同主族自上而下金属性增强;
(2)同周期自左而右原子半径减小;
(3)由于同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,最高价含氧酸的酸性越强;
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO等;
(5)表中两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应;
(6)M是仅含非金属的盐,所以M一定是铵盐,Z→N→⑥的单质,⑥为Al,推断N是氧化铝,Z是氢氧化铝,根据产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应.
解答 解:由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)由于同周期自左而右金属性减弱、同主族自上而下金属性增强,故上述元素中Na的金属性最强,故答案为:Na;
(2)同周期自左而右原子半径减小,故原子半径:Na>Al,故答案为:Na>Al;
(3)非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HNO3>H2CO3>H2SiO3 ,故答案为:HNO3>H2CO3>H2SiO3 ;
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO等,对应的电子式为: 、
、 ,故答案为:
,故答案为: 或
或 ;
;
(5)两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
故答案为:ab;
(6)M是仅含非金属的盐,所以M一定是铵盐,Z→N→⑥的单质,⑥为Al,推断N是氧化铝,Z是氢氧化铝,根据产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应,则X溶液与Y溶液反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,N→⑥的单质的化学方程式为:2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$ 4Al+3O2↑,
故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$ 4Al+3O2↑.
点评 本题考查元素周期表与元素周期律、元素化合物推断等,侧重对元素周期律与化学用语的考查,注意对元素周期表的整体把握,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 迄今人类发现的元素中,金属元素和非金属元素种数相近 | |
| B. | 元素周期表有18个纵行16个族,分为主族、副族、第Ⅷ族和零族 | |
| C. | 元素周期表有七个周期,分为短周期和长周期和不完全周期 | |
| D. | 人们在周期表中金属与非金属的分界处可以找到半导体材料,如硅、锗等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PCl5固体是分子晶体 | |
| B. | PCl5固体有良好的导电性 | |
| C. | PCl5晶体由[PCl4]+和[PCl6]-构成,其离子数目之比为1:1 | |
| D. | PCl5晶体由[PCl3]2+和[PCl7]2-构成,其离子数目之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g乙烯和丙烯的混合气体中含有H原子数为2NA | |
| B. | 标准状况下2.24L乙醇与足量Na反应生成H2分子数0.05NA | |
| C. | 每摩尔-CH3中含10NA个电子 | |
| D. | 每摩尔甲苯中含有的碳碳单键的数目为7 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com