
【题目】采用电化学法还原CO2是一种使CO2资源化的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )

A. Pb与电源的正极相连
B. ZnC2O4在离子交换膜右侧生成
C. 正极反应式为:Zn﹣2e﹣═Zn2+
D. 标准状况下,当11.2 L CO2参与反应时,转移0.5mol电子
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应时,下列措施不能使产生氢气的速率加快的是
A.加热 B.滴加少量CuSO4溶液
C.不要稀硫酸,改用98%浓硫酸 D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3是两种常见的钠盐.
(1)下列关于Na2CO3和NaHCO3性质的说法中,正确的是
a.常温下,Na2CO3在水中的溶解度比NaHCO3小
b.相同质量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2前者多
c.可用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液
d.等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2的体积相同
(2)实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:物质A是 , 写出实验中所发生的化学方程式 . 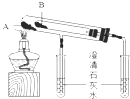
(3)若要除去碳酸钠溶液中的少量碳酸氢钠,请用化学方程式表示除杂原理 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) ΔH=-a kJ·mol-1(a>0)。下列说法不正确的是( )
3Z(g) ΔH=-a kJ·mol-1(a>0)。下列说法不正确的是( )
A. 0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol
B. 达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C. 达到化学平衡状态时,反应放出的总热量可达a kJ
D. 升高反应温度,逆反应速率增大、正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )

A. 滤纸上c点附近会变红色
B. Cu电极质量减小,Pt电极质量增大
C. Z中溶液的pH先减小,后增大
D. 溶液中的SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物广泛存在于自然界中,回答下列问题:
(1)碳在形成化合物时,其键型以共价键为主,原因是__________。
(2)CS2分子中,共价键的类型有_______ , C原子的杂化轨道类型是______,写出两个与CS2具有相同空间构型的分子或离子_______。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是______;
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(g)+ N2H4(g)=2N2(g)+4H2O(g) △H=-1038.7kJ/mol。若该反应中有4molN-H键断裂,则形成的π键有___mol。
③肼能与硫酸反应生成N2H6SO4, N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在____ (填标号)。
a.离子键 b.共价键 c.配位键 d.范德华力
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图29所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为______。其晶胞参数(晶胞边长)为1.4nm,晶体密度为____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )
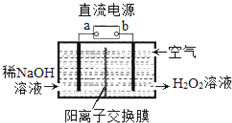
A. a为负极
B. 通入空气的电极反应式为O2+2e﹣+2H+═H2O2
C. 电解一段时间后,左侧溶液pH降低
D. 若生成17g双氧水,则有1molH+从左侧向右侧迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com