
| A. | 丙烯分子中3个碳原子都是sp3杂化 | |
| B. | 每个丙烯分子有7个σ键,1个π键 | |
| C. | 丙烯分子是存在非极性键和极性键的极性分子 | |
| D. | 丙烯分子为手性分子 |
分析 A、甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化;
B、C-C、C-H键均为σ键,C=C中一个σ键,一个π键;
C、同种非元素之间形成非极性键;
D、一个碳与四个不同原子或原子团相连.
解答 解:A、甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化,所以丙烯分子中3个碳原子不是全部sp3杂化,故A错误;
B、C-C、C-H键均为σ键,C=C中一个σ键,一个π键,故B错误;
C、同种非元素之间形成非极性键,碳碳键是非极性键,碳氢键是极性键,故C正确;
D、一个碳与四个不同原子或原子团相连,CH3-CH=CH2分子中无手性碳,故D错误;
故选C.
点评 本题考查共价键及分类,注意判断共价键的规律和常见有机物的空间结构来解答,杂化类型为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
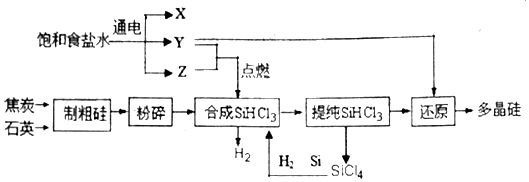
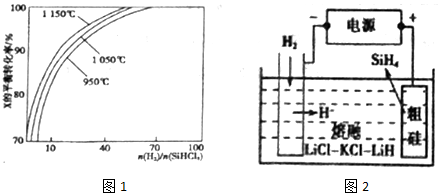
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | H2C2O4 | HF | H2CO3 | H3BO3 |
| 电离平衡常数Ka | Ka1=5.9×10-2 Ka2=6.4×10-5 | 未知 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 5.8×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19:8 | B. | 22:1 | C. | 13:8 | D. | 8:13 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
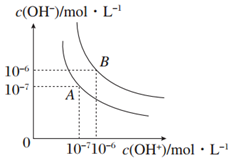 回答下列问题
回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 非电解质 | 混合物 | 氧化物 | 弱电解质 | |
| A | Cu | 淀粉 | CuO | HClO |
| B | SO3 | 水玻璃 | Na2O•CaO•6SiO2 | H3PO4 |
| C | CH3CH2OH | KAl(SO4)2•12H2O | KClO3 | NH3•H2O |
| D | 葡萄糖 | 普通玻璃 | H2O | H2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫氰酸钾溶液 | B. | NaOH溶液 | ||
| C. | 新制氯水、硫氰酸钾溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要参加反应的Na2O2的物质的量一定,反应生成的氧气的量就一定 | |
| B. | 只要CO2和H2O(g)的中的物质的量一定,反应所消耗的Na2O2的量就一定 | |
| C. | 只要混合气体的总的物质量一定,反应中所转移的电子的物质的量就一定 | |
| D. | 只要混合气体的总的物质的量一定,固体所增加的质量就一定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
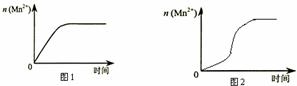 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3 mol/L 稀H2SO4 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | V1 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | V2 | ||
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 在向试管中加 入少量固体 | 室 温 下溶液颜 色 褪 至 无 色 所 需时间/min | |||
| 0.6mol/L H2C2O4 溶液 | H2O | 0.2mol/L KMnO4 溶液 | mol/L 稀 硫酸 | |||
| 4 | 3.0 | 2.0 | 2.0 | t | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com