
1.00 L 0.500 mol·L-1 NaOH溶液与足量的稀盐酸反应,放出 28.7 kJ的热量。表示该反应的中和热的热化学方程式正确的是
A.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);ΔH=+28.7 kJ·mol-1
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);ΔH=-28.7 kJ·mol-1
C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);ΔH=+57.4 kJ·mol-1
D.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);ΔH=-57.4 kJ·mol-1
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A、T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | ||
| B、500s内N2O5分解速率为2.96×10-3mol?L-1?s-1 | ||
| C、T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50% | ||
D、达平衡后其他条件不变,将容器的体积压缩到原来的
|
查看答案和解析>>
科目:高中化学 来源:2013届黑龙江省哈尔滨九中高三第四次(12月)月考化学试卷(带解析) 题型:填空题
(12分)某兴趣小组为研究乙酸乙酯的制取,进行如下实验。
实验一 用乙醇和乙酸制取乙酸乙酯
甲、乙同学分别使用图1、图2装置制取乙酸乙酯。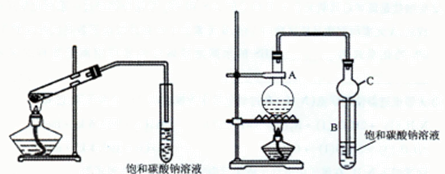
图1 图2
(1)制取乙酸乙酯的化学方程式为
(2)将饱和碳酸钠溶液换成氢氧化钠溶液是否可行,并解释原因
(3)图1导管末端不能插入饱和碳酸钠溶液,而图2装置中的仪器C的末端可以插入饱和碳酸钠溶液的原因是
实验二 测定乙酸乙酯的纯度
取乙同学所得乙酸乙酯样品1.0 g,放入20.00 mL 0.500 mol.L-1的NaOH溶液中,充分振荡四小时,滴入两滴酚酞后,用0.075 mol·L-1的盐酸标准溶液滴定,重复三次实验测得盐酸用量的平均值为20.00 mL。
(4)该乙酸乙酯样品的纯度为
(5)达到滴定终点时,溶液颜色由 变为
(6)下列操作能引起乙酸乙酯纯度偏低的原因是
| A.酸式滴定管未润洗 | B.酸式滴定管滴定前有气泡,滴定后气泡消失 |
| C.配制盐酸标准液时,定容俯视 | D.乙酸乙酯未完全水解 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省高三第四次(12月)月考化学试卷(解析版) 题型:填空题
(12分)某兴趣小组为研究乙酸乙酯的制取,进行如下实验。
实验一 用乙醇和乙酸制取乙酸乙酯
甲、乙同学分别使用图1、图2装置制取乙酸乙酯。

图1 图2
(1)制取乙酸乙酯的化学方程式为
(2)将饱和碳酸钠溶液换成氢氧化钠溶液是否可行,并解释原因
(3)图1导管末端不能插入饱和碳酸钠溶液,而图2装置中的仪器C的末端可以插入饱和碳酸钠溶液的原因是
实验二 测定乙酸乙酯的纯度
取乙同学所得乙酸乙酯样品1.0 g,放入20.00 mL 0.500 mol.L-1的NaOH溶液中,充分振荡四小时,滴入两滴酚酞后,用0.075 mol·L-1的盐酸标准溶液滴定,重复三次实验测得盐酸用量的平均值为20.00 mL。
(4)该乙酸乙酯样品的纯度为
(5)达到滴定终点时,溶液颜色由 变为
(6)下列操作能引起乙酸乙酯纯度偏低的原因是
A.酸式滴定管未润洗 B.酸式滴定管滴定前有气泡,滴定后气泡消失
C.配制盐酸标准液时,定容俯视 D.乙酸乙酯未完全水解
E.乙酸乙酯中含有乙酸 F.锥形瓶未润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
1.00 L 0.500 mol·L-1 NaOH溶液与足量的稀盐酸反应,放出 28.7 kJ的热量。表示该反应的中和热的热化学方程式正确的是
A.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);ΔH=+28.7 kJ·mol-1
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);ΔH=-28.7 kJ·mol-1
C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);ΔH=+57.4 kJ·mol-1
D.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);ΔH=-57.4 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com