
下列实验中固体物质可以完全溶解的是
A.1 mol MnO2与含2 mol H2O2的溶液共热
B.1 mol铜投入含4 molHNO3的浓硝酸中
C.1 mol铜与含2 molH2SO4的浓硫酸共热
D.常温下l mol铝片投入到足量浓硫酸中
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列选项中有关物质性质实验得到的结论正确的是( )
|
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
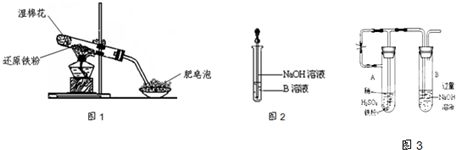
(19分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。

(1)写出该反应的化学方程式 ,其中氧化剂是 ,还原剂是 。8.4g铁粉参加反应,转移电子 mol。
(2)玻璃管中石棉绒的作用是 ,实验开始时应先点燃 ,实验结束时应先熄灭 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶里应事先放置 ,其作用是 。
(4)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的
成分是 ,若溶液未变红色则说明硬质试管中固体物质的
成分是 。
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是
(用离子方程式表示)。
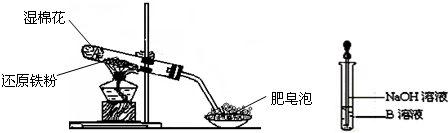
(6)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按上图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关
的反应的化学方程式 ,
。
(7)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+ 具有 性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是 ,
并且配制含Fe2+的盐溶液时应加入少量 。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年广东省梅州市曾宪梓中学高一上学期期末考试化学试卷 题型:实验题
(19分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
(1)写出该反应的化学方程式 ,其中氧化剂是 ,还原剂是 。8.4g铁粉参加反应,转移电子 mol。
(2)玻璃管中石棉绒的作用是 ,实验开始时应先点燃 ,实验结束时应先熄灭 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶里应事先放置 ,其作用是 。
(4)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的
成分是 ,若溶液未变红色则说明硬质试管中固体物质的
成分是 。
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是
(用离子方程式表示)。
(6)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按上图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关
的反应的化学方程式 ,
。
(7)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+ 具有 性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是 ,
并且配制含Fe2+的盐溶液时应加入少量 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com