
【题目】用CO2和H2合成甲醇的化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) H,按相同的物质的量投料,测得CO2在不同温度下(T1< T2)的平衡转化率与压强的关系如下图所示。下列说法正确的是
CH3OH(g)+H2O(g) H,按相同的物质的量投料,测得CO2在不同温度下(T1< T2)的平衡转化率与压强的关系如下图所示。下列说法正确的是
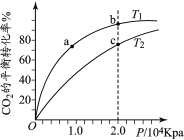
A.该反应的ΔH>0B.正反应速率:υ(a)>υ(c)
C.CH3OH的体积分数:φ(b)<φ(a)D.平衡常数:K(b)>K(c)
【答案】D
【解析】
A. 根据CO2的平衡含量与温度的关系,结合平衡移动原理分析;
B. 利用温度、压强对化学反应速率的影响分析;
C. 在温度不变时,利用压强对平衡移动的影响分析判断;
D. 化学平衡常数只与温度有关,根据温度对平衡移动的影响分析。
A. 由于温度:T1<T2,根据图象可知:升高温度,平衡时CO2(g)转化率降低,说明升高温度,化学平衡逆向移动,由于升高温度化学平衡向吸热反应方向移动,逆反应为吸热反应,则该反应的正反应为放热反应,故该反应的ΔH<0,A错误;
B. c点的温度、压强比b点大。由于升高温度反应速率加快;增大压强化学反应速率加快,所以正反应速率υ(a)<υ(c),B错误;
C. a、b两点反应温度相同,压强:b>a,在温度不变时,增大压强化学平衡向气体体积减小的正反应方向移动,反应达到平衡后,由于气体总物质的量减小,甲醇的物质的量增加,所以CH3OH的体积分数:φ(b)>φ(a),C错误;
D. 根据选项A分析可知:该反应的正反应为放热反应,ΔH<0,温度:T1<T2,升高温度,化学平衡向吸热的反应热方向移动,所以化学平衡常数K(b)>K(c),D正确;
故合理选项是D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铜铁是目前人们使用量最大的合金材料,铁及其化合物也是人们日常生活中应用广泛的一类物质。回答下列问题:
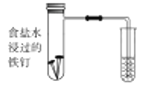
(1)下图中铁钉发生的电化学腐蚀类型是________,负极反应式为__________。
(2)实验室配置![]() 溶液时,需向溶液中滴加几滴稀硫酸,其目的是__________,
溶液时,需向溶液中滴加几滴稀硫酸,其目的是__________,![]() 溶液中离子浓度由大到小的顺序是________。
溶液中离子浓度由大到小的顺序是________。
(3)高铁盐酸是一种新型的环境消毒剂及水体净化剂,如高铁酸钾(![]() )。其中
)。其中![]() 的化合价是________,其净水过程中既表现出强氧化性,又表现了强吸附性,则
的化合价是________,其净水过程中既表现出强氧化性,又表现了强吸附性,则![]() 与水反应的离子方程式为__________。
与水反应的离子方程式为__________。
(4)羰基铁酸[![]() ]是一种二元弱酸,其第一步电离方程式为__________。
]是一种二元弱酸,其第一步电离方程式为__________。
(5)25℃时,向含![]() 的溶液中加入一定量的
的溶液中加入一定量的![]() 后,
后,![]() 恰好达到溶液平衡,测得溶液的
恰好达到溶液平衡,测得溶液的![]() ,
,![]() 。通过计算判断所得的
。通过计算判断所得的![]() 中是否含有
中是否含有![]() 杂质:________(已知:
杂质:________(已知:![]() ,
,![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学课外兴趣小组通过实验探究Fe2+、Fe3+的性质。回答下列问题:
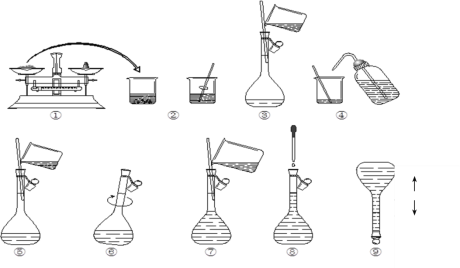
(1)本次实验中共需要1mol/LFeCl2溶液100 mL,配制时涉及到如下操作:
①步骤③中玻璃棒的作用是__;
②在配制溶液过程中步骤⑦所进行的操作是___(填“洗涤”、“转移”、“定容”);该步中视线应与溶液凹液面的最低处保持___。
③下列操作会使所配溶液物质的量浓度偏低的是___。
A.溶解后小烧杯、玻璃棒没有洗涤
B.所用容量瓶中,已有少量蒸馏水
C.定容、加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线
(2)取2mLFeCl2溶液于试管中,加入几滴氯水,再加入1滴KSCN溶液,观察到的现象为__,说明Cl2可将Fe2+氧化成Fe3+。FeCl2溶液与氯水反应的离子方程式为___,此时将所取FeCl2溶液完全反应需__molCl2。
(3)在(2)溶液中加入过量的铁粉,溶液变成___色;发生反应的离子方程式为__,此时溶液中所含铁元素的微粒的物质的量为__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气,其变化可表述为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl↑2+8H2O。
(1)请将上述化学方程式改写为离子方程式:__。
(2)浓盐酸在反应中显示出来的性质是__(填编号)。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
(3)此反应中氧化产物是Cl2,若产生0.5molCl2,则转移电子的物质的量为__mol。
(4)用双线桥法表示该反应电子转移的方向和数目__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. ![]() 是一元羧酸,对应的酸根是
是一元羧酸,对应的酸根是![]()
B. ![]() 不是天然氨基酸,但它可以和甘氨酸反应形成肽键
不是天然氨基酸,但它可以和甘氨酸反应形成肽键
C. 葡萄糖溶液中加入新制![]() 悬浊液可看到有砖红色沉淀生成
悬浊液可看到有砖红色沉淀生成
D. 纤维素的水解和油脂的皂化反应都是由高分子生成小分子的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计下图装置进行电解饱和食盐水自制“84”消毒液。回答下列问题

(1)电解饱和食盐水时,a连接电源的_________极(填“正”或“负”)。
(2)利用该装置自制消毒液的化学反应方程式是_________。
(3)①“84”消毒液不用时需要密封保存,否则会与空气中_________发生反应,生成不稳定的物质。
②该同学利用传感技术进行某溶液中次氯酸的稳定性实验。用强光照射盛有该溶液的广口瓶,过程中溶液的pH、Cl-的浓度、瓶中氧气的体积分数变化如下图:
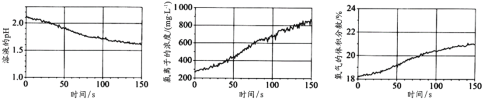
该同学分析数据得出的结论是_________(用化学方程式表示)。
(4)“84”消毒液不能与洁厕灵混用,也不能与消毒酒精混用,请从物质性质的角度解释“84”消毒液不能与消毒酒精混用的原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
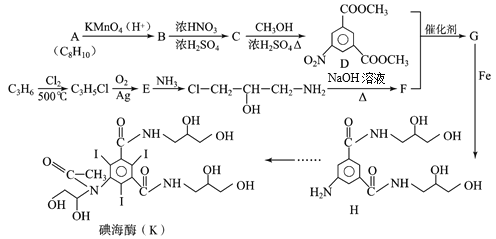
【题目】碘海醇是一种临床中应用广泛的非离子型造影剂,具有耐受性好,毒性低等优点,利用碘海醇做造影剂进行肺部CT检查,能为新冠肺炎确诊及治疗提供重要参考,碘海醇的一种合成路线如下:
已知:①![]()
②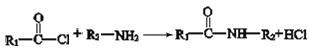
(1)已知A是苯的同系物,则A的结构简式为________。
(2)C中所含官能团的名称为_________。
(3)写出C→D的化学反应方程式_________。
(4)E的结构简式为_______。
(5)M与B互为同分异构体,M是含有苯环的酯类物质,能发生银镜反应,且苯环上一氯取代物有两种。写出任意一种符合上述条件的M的结构简式________。
(6)上述合成路线中,由合成碘海醇过程如下,下列说法正确的是________。
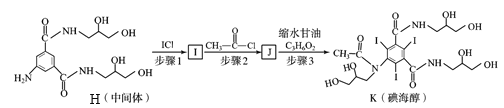
a. 步骤1中1 mol H需消耗3 mol ICl,并且有副产物HCl生成
b. 步骤2和步骤3中的反应类型相同
c. 碘海醇极易溶于水与其结构中存在较多的羟基有关
(7)有机物Q(C3H8O3)可由油脂水解制得,已知合成路线中的物质B可与Q形成交联聚合物P,P的结构片段如下:
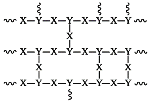
①其中![]() 的结构简式为_______。
的结构简式为_______。
②写出一定条件下相同物质的量的B与Q反应,形成线型高分子的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含镍废硫酸盐(含 Ni2+ 、Fe2+ 、Cu2+ 、Co2+ 、A13+ 、Mn2+ 、Cr3+ 、Mg2+ 、Zn2+ 等)为原料制取NiSO4·6H2O 的工艺流程如下:
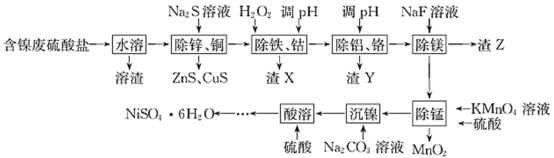
相关金属离子形成氢氧化物沉淀的pH 范围如下:
金属离子 | Co2+ | Co3+ | Fe2+ | Fe3+ | A13+ | Cr3+ | Ni2+ |
开始沉淀的pH | 7.2 | 0.23 | 6.3 | 1.5 | 4.1 | 4.3 | 6.9 |
沉淀完全的pH | 9.2 | 1.1 | 8.3 | 2.8 | 5.4 | 5.6 | 8.9 |
回答下列问题:
(1)已知1gKsp(CuS)= -47.6,1gKsp(ZnS)= -23.8,则反应ZnS+Cu2+![]() CuS+Zn2+的平衡常数对数值1gK= ________________________。
CuS+Zn2+的平衡常数对数值1gK= ________________________。
(2)“除铁、钴”时,加入H2O2的目的是 ______________,得到的渣X为________。
(3) “除铝、铬”时,调pH 范围为 _________;滤渣Y 中含Cr(OH)3,其性质与 A1(OH)3 类似,写出Cr(OH)3与NaOH反应的化学方程式: __________________。
(4)“除锰”时,发生反应的离子方程式为___________________________。
(5)“酸溶”得到溶液制备 NiSO4·6H2O晶体,还需进行的操作工艺是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚和乙醇是两种常见的有机溶剂,也可作为新能源。
(1)通过以下反应可获得二甲醚(CH3OCH3):
①CO(g)+H2O(g)=CO2(g)+H2(g) ΔH 1=a kJ·molˉ1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH 2=b kJ·molˉ1
③2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH 3=c kJ·molˉ1
则反应 2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的 ΔH=_________kJ·molˉ1。
(2)已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g) ![]() CH3CH2OH(g)。
CH3CH2OH(g)。
在 n(H2O)∶n(C2H4)=1∶1 的条件下投料,乙烯的平衡转化率与温度(T)及压强(p) 的关系如图1所示。
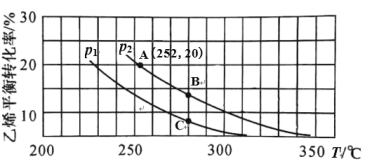 图1
图1
①下列有关说法中正确的是_________。
A.p1>p2 B.280℃时,vB>vC
C.A、B、C 三点的平衡常数 KA>KB>KC D.低温有利于该反应自发进行
②在 p2,280℃条件下,C 点的 v 正 ____v 逆 (填“>”、“<”或“=”),理由是________。
③计算图 1 中 A 点的平衡常数 Kp=_________。(结果用 p2 的代数式表示,平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
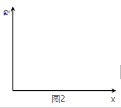
(3)在 n(H2O)∶n(C2H4)=1∶x 的条件下投料,某研究小组在压强为 p2,温度为 252℃ 时,进行平衡体系中乙醇的体积分数随投料比变化的测定实验。在图 2 中画出平衡体系中乙醇的体积分数 φ 随 x 变化的示意图____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com