
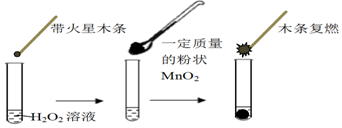
| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气 泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
分析 (1)H2O2在MnO2催化作用下分解生成水和氧气;
(2)根据表格中数据,二氧化锰质量的增加,相同时间内收集到氧气的体积也相应增加,说明反应速率加快,从而得出结论;
(3)从所给的数据可知:试管Ⅰ、试管Ⅱ所用试剂的浓度、用量完全一样,产生气泡的快慢不一样,说明不同催化剂对反应的催化效果不一样,要对比Fe3+和Cu2+对H2O2分解反应的催化效果,必须排除溶液中的阴离子是否有催化作用,试管Ⅲ就很好的解决了这个问题;
(4)根据化合价的升降和催化剂会参加反应,但最终性质和质量不改变写出反应方程式.
解答 解:(1)H2O2在MnO2催化作用下分解生成水和氧气,反应的方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)根据表格中数据,在一定质量范围内,二氧化锰质量的增加,相同时间内收集到氧气的体积也相应增加,说明反应速率加快,原因是在一定质量范围内,固体质量越大,其表面积也越大,故反应速率加快,催化效果更好;
故答案为:在一定质量范围内,MnO2质量越大,反应速率越快;
(3)从所给的数据可知:试管Ⅰ、试管Ⅱ所用试剂的浓度、用量完全一样,产生气泡是试管Ⅰ快,试管Ⅱ慢,试管Ⅲ无气泡产生,试管Ⅲ是一个对比实验,说明Cl-对H2O2的分解没有催化作用,从而得到Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好的结论,
故答案为:Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好;对比实验,证明Cl-对H2O2的分解没有催化作用;
(4)根据化合价的升降和催化剂会参加反应,但最终性质和质量不改变写出反应方程式,FeCl3和H2O2反应,FeCl3中铁元素化合价降低,生成氯化亚铁,双氧水中氧元素化合价升高,生成氧气,方程式为:2FeCl3+H2O2=2FeCl2+O2↑+2HCl;FeCl3作催化剂,在第二个反应中重新生成,氯化亚铁又被双氧水氧化成氯化铁,方程式为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O;
故答案为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O.
点评 本题考查了催化剂在反应中起到的作用,以及催化剂的质量大小对反应速率的影响探究,并考查了对比实验的重要性,结合催化剂的特点分析催化机理,并对方程式进行推导,综合性较强,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2V正(B)=V逆(D) | |
| B. | 混合气体的密度保持不变 | |
| C. | 混合气体中B、C、D的浓度之比为2:2:1 | |
| D. | 混合气体的压强不随时间变化而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,加入催化剂,不影响CO的转化率 | |
| D. | 二氧化硫的催化氧化是一个放热反应,升高温度,平衡逆向移动,正反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol A+2 mol B | |
| B. | 1 mol B+3 mol C+1 mol D | |
| C. | 3 mol C+2 mol D | |
| D. | 1 mol A+0.5 mol B+1.5 mol C+0.5 mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
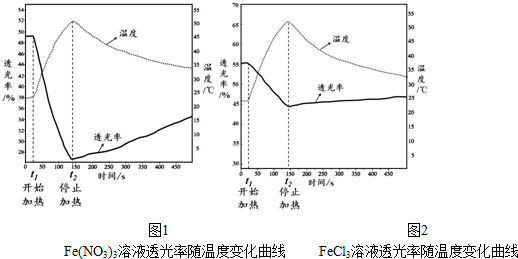
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
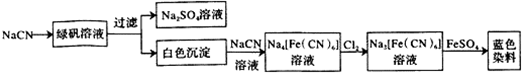
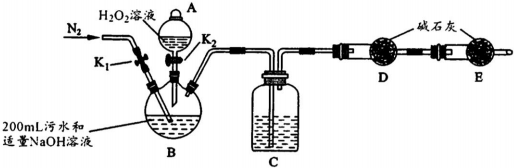
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热. |
| 步骤2 | 冷却后,用注射器穿过B装置的胶塞注入稀H2S04溶液. |
| 步骤3 | 打开K1,通入N2. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com