
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。某温度下,将2molSO2和1molO2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0。某温度下,将2molSO2和1molO2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )

A.由图甲知,A点SO2的平衡浓度为0.08mol·L-1
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达到平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50MPa时不同温度下SO2的转化率与温度关系如丙图,则T2>T1
【答案】C
【解析】
A. 由甲图可知A点SO2的转化率为0.8,二氧化硫起始浓度乘以转化率为二氧化硫的浓度变化量,据此计算△c(SO2)=2mol×0.8/10L=0.16mol/l,平衡时的浓度为(0.2-0.16)mol/L=0.04mol/L,A项错误;
B. 由甲图可知B点SO2的转化率为0.85,所以△n(SO2)=0.85×2mol=1.7mol,则: ,B点SO2、O2、SO3的平衡浓度之比为0.3:0.15:1.7=6:3:34,B项错误;
,B点SO2、O2、SO3的平衡浓度之比为0.3:0.15:1.7=6:3:34,B项错误;
C. 达平衡后,缩小容器容积,反应混合物的浓度都增大,正、逆反应速率都增大,体系压强增大,平衡向体积减小的反应移动,即平衡向正反应移动,故v(正)>v(逆),C项正确;
D. T1达平衡的时间短,温度为T1,先到达平衡,反应速率快,温度越高反应速率越快,故T2<T1,D项错误;
答案选C。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】硝酸在化学工业中有着极其广泛的应用。
(1)将1.25mol的NO、NO2、N2O4混合物(其中NO的体积分数为0.60)通入水中,在空气充足的条件下完全反应后可获得硝酸的物质的量范围是_______________。
(2)向稀硝酸中加入18.4mol/L的浓硫酸(98%)作吸水剂并蒸馏得浓硝酸,当其浓度下降到87%(密度1.8g/cm3)以下时,则失去吸水能力。50mL 18.4mol/L的浓硫酸作为吸水剂时,最多可吸水_________ g。
(3)在65%的HNO3(质量m1)中加入72%的Mg(NO3)2(质量m2)后蒸馏,分别得到97.5%的HNO3和60%的Mg(NO3)2溶液(其中不含硝酸)。若蒸馏过程中,硝酸、硝酸镁均无损耗,H2O的损耗占总质量的5%,则蒸馏前投料比![]() =______________。
=______________。
(4)硝酸工业中的尾气用烧碱进行吸收产物为NaNO2、NaNO3和H2O。现有含0.50mol氮氧化物的尾气,恰好被一定量的NaOH溶液完全吸收。已知反应后溶液含有0.35mol NaNO2。若将尾气NO和NO2的平均组成用NOx表示,则x =___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上联合生产碳酸氢钠和氯代烃的工艺流程如图所示,在生产NaHCO3的过程中完成乙烯氯化,下列叙述错误的是
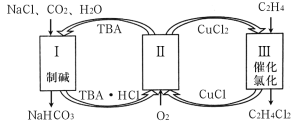
A.过程Ⅰ中的TBA替代了侯德榜制碱法中的氨气
B.在过程Ⅱ中实现了TBA、CuCl2的再生
C.理论上每生成1mol NaHCO3,可得到1mol C2H4Cl2
D.过程Ⅲ中的反应是C2H4+2CuCl2![]() C2H4Cl2+2CuCl
C2H4Cl2+2CuCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温室气体CO2资源化利用的一种途径如下,生成物H和I可用作锂离子电池的电解质。

回答下列问题:
(1)由A到B的反应类型为_____;由C到D的反应所需试剂为______。
(2)E中官能团的名称是_____,最多_______个原子共线。
(3)F合成G的化学方程式为_______。
(4)与G互为同分异构体的羧酸类芳香族化合物中,核磁共振氢谱为四组峰,峰面积之比为6:2:1:1的结构简式为____。
(5)设计由丙炔和甲醛为起始原料制备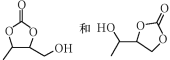 的合成路线(无机试剂任选)______。
的合成路线(无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是( )
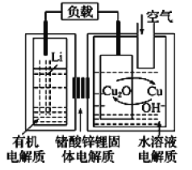
A.该电池的负极为Li
B.通空气时,铜被腐蚀,表面产生Cu2O
C.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
D.若有1 mol Li+透过固体电解质时,标准状况下参与反应的O2体积为5.6 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种合成强效降血脂药物(G)的“片段”如下:
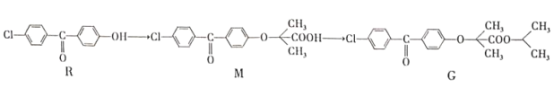
下列说法正确的是
A.R、M、G都能发生加成、取代反应B.R、M、G都有3种含氧官能团
C.M分子中所有碳原子可能共平面D.G分子中苯环上二溴代物有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物说法不正确的是( )
A.BrCH2CHBrCH2Br的名称为三溴丙烷
B.萘环![]() 上的一个H原子被一C4H9取代后的产物共有8种
上的一个H原子被一C4H9取代后的产物共有8种
C.对甲基苯乙烯中最多有17个原子共面
D.立方烷 一氯代物1种、二氯代物有3种、三氯代物也有3种
一氯代物1种、二氯代物有3种、三氯代物也有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、P、As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题:
(1)意大利罗马大学的Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为______________________,N—N键的键角为______________________;
(2)基态砷原子的价电子排布图为______________________,砷与同周期相邻元素的第一电离能由大到小的顺序为______________________;
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。PH3与NH3的结构相似,和过渡金属更容易形成配合物的是____________________(填“PH3”或“NH3”)。
(4)SCl3+和PCl3是等电子体,SCl3+的空间构型是____________________;S—Cl键键长 ______P-Cl键键长(填“>”、“=”或“<”),原因是____________________。
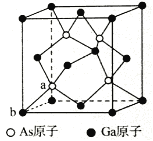
(5)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,砷化镓的化学式为____________________。若该晶体的密度为ρg/cm3,设NA为阿伏加德罗常数的值,则a、b的距离为_________pm(用含ρ和NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com