
 500℃、60.0MPa条件下,合成氨原料气投料比与平衡时NH3体积分数的关系:
500℃、60.0MPa条件下,合成氨原料气投料比与平衡时NH3体积分数的关系:| A、反应到达平衡状态时升高温度,混合气体的平均相对分子质量增大 |
| B、原料气中H2的比例越大,平衡混合气体中NH3的体积分数就越高 |
| C、图中a点H2的平衡体积分数为43.5% |
| D、平衡状态时移走部分氨气,保持条件不变,△H减小 |
| 3 |
| 4 |
| 3 |
| 2 |
| 43.5 |
| 100 |


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C(OH-)<C(H+) |
| B、C(HX)>C(x-) |
| C、C(HX)+C(x-)=2C(Na+) |
| D、C(H+)+(Na+)=C(X-)+C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.
常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.| 密度/g?cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液体烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:
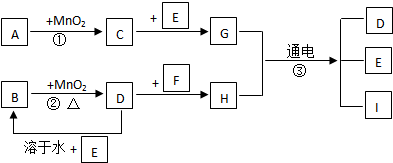
查看答案和解析>>
科目:高中化学 来源: 题型:
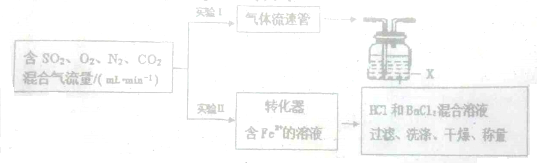
查看答案和解析>>
科目:高中化学 来源: 题型:
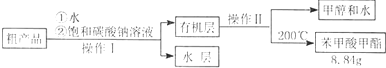
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | Mg | Al | NaOH溶液 | 过滤 |
| C | FeCl2 | FeCl3 | Cu | 过滤 |
| D | MgCl2 | FeCl3 | MgO | 过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
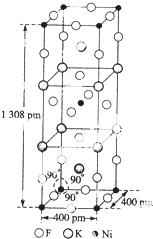 尿素(H2NCONH2 )可用于制有机铁肥.主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]
尿素(H2NCONH2 )可用于制有机铁肥.主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com