
【化学——选修2:化学与技术】(15分)
某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:
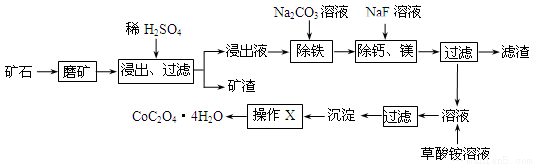
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。

(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4;
CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2 + C6  CoO2 + LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2 + LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
(除标记外每空2分,共15分)
(1)12 90
(2)3 ,6,6,1,5,6 (有错计0分,“1”未写本次不扣分)
(3)1.50(或1.5)
(4)SO42-、NH4+、Na+ (少一个扣1分,有错计0分) 洗涤、低温干燥(各1分)
(5)0(1分) 7g
【解析】
试题分析:(1)根据五行可知,温度太低浸出率较低,而90℃与120℃时的浸出率差不太多,而温度太高消耗的能量较多,生产成本大,所以最佳的温度是90℃,12小时时浸出率基本达到最大,再增长时间,浸出率增大不多,所以最佳的浸出时间是12小时;
(2)该反应不是氧化还原反应,所以只需按照质量守恒定律配平即可,Fe元素守恒,则硫酸铁的系数是3,Na2Fe6(SO4)4(OH)12的系数是1,则硫酸钠的系数是5,所以碳酸钠的系数是6,二氧化碳为6,水是6;
(3)加入过量NaF溶液,则生成MgF2和CaF2沉淀,则滤液为二者的饱和溶液,溶液中的氟离子浓度相等,所以滤液中的c(Ca2+)/c(Mg2+)= KSP(CaF2)/ KSP(MgF2)= 1.11×10-10/7.4×10-11=1.5;
(4)根据流程图分析,除铁、钙、镁的过程中都生成硫酸钠,加入草酸铵后生成草酸钴沉淀,则该沉淀中可能存在的杂质离子有SO42-、NH4+、Na+;将得到的沉淀洗涤以除去杂质离子,然后低温干燥,防止草酸钴分解;
(5)充电时,Li+还原为Li,则LiCoO2 中Li的化合价是+1价,所以LiC6中Li的化合价Li的化合价是0价;放电时正极发生还原反应,则CoO2得到1个电子与锂离子结合为LiCoO2,所以放电时有1mole-转移,则有1mol LiCoO2生成,正极CoO2增加的质量即为1molLi的质量为7g。
考点:考查对图像的分析判断,化学方程式的配平,溶度积的应用,电化学反应原理的应用
考点分析: 考点1:离子反应 考点2:氧化还原反应 考点3:电化学基础 考点4:溶解平衡 考点5:离子浓度比较 试题属性

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015山东省枣庄市高一上学期期末化学试卷(解析版) 题型:选择题
现有两瓶溶液,新制饱和氯水和亚硫酸溶液,下列方法或试剂(必要时可加热):①观察颜色 ②石蕊试液 ③品红溶液,其中能用于鉴别它们的是
A.①②③ B.只有①③ C.只有②③ D.只有①②
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省六校高三3月联考理综化学试卷(解析版) 题型:选择题
将反应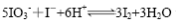 设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是
设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是
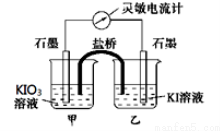
A.开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应
B.开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝
C.电流计读数为零时,反应达到化学平衡状态
D.两次电流计指针偏转方向相反
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三3月模拟考试理综化学试卷(解析版) 题型:实验题
(19分)某研究性学习小组学生根据氧化还原反应规律,探究NO2、NO与Na2O2反应的情况,提出假设并进行相关实验。
I.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2氧化Na2O2。
(1)甲同学设计如图装置进行实验:
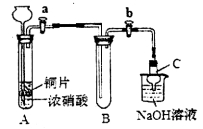
①试管A中反应的离子方程式是___________。
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为__________。
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是________________。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设正确。则NO2和Na2O2反应的化学方程式是_______________。
II.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2==2NaNO2;2NaNO2+2HCl==2NaCl+NO2↑+NO↑+H2O:酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+。
(3)丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
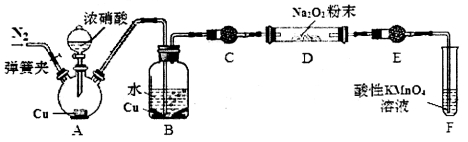
①在反应前,打开弹簧夹,通入一段时间N2,目的是____________________。
②B中观察到的主要现象的是_________(填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是______(填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为_________________。
⑤充分反应后,检验D装置中产物的方法是:取D装置中产物少许,__________________,则产物是NaNO2。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三3月模拟考试理综化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.向NH4HCO3溶液中加过量NaOH溶液并加热: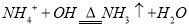
B.用KIO3氧化酸性溶液的KI: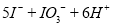 ==
==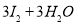
C.向Ba(OH)2溶液中滴加稀硫酸: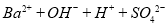 ==
==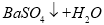
D.用稀硝酸洗涤试管内壁的银镜: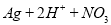 ==
==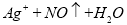
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期。下列说法错误的是
A.原子半径:Z>R>W
B.气态氢化物稳定性:HmW>HnR
C.Y、Z、R三种元素组成的化合物水溶液一定显碱性
D.X2W6分子中各原子均满足8电子结构
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:实验题
(14分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
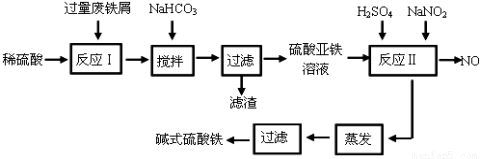
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9. 7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为 。
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知: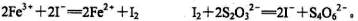
则溶液中铁元素的总含量为 g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将
会 (填“偏高” “偏低” “不变”)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
下列关于有机物的说法正确的是
A.棉花、羊毛、蚕丝均属于天然纤维素
B.石油的分馏和裂化均属于化学变化
C.油脂都不能使溴的四氯化碳溶液褪色
D.甲烷、乙醇、乙酸在一定条件下都能发生取代反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市石景山区高三上学期期末考试化学试卷(解析版) 题型:选择题
某同学组装了如图所示的原电池装置,下列叙述中正确的是

A.电流方向:电极Ⅱ→ →电极Ⅰ
→电极Ⅰ
B.电极Ⅱ逐渐溶解
C.电极Ⅰ上发生还原反应
D.盐桥中装有含氯化钾的琼脂,Cl向右池移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com