
| 1 |
| 2 |
| A、-(2b+2c-a)kJ?mol-1 |
| B、-(a-2b-2c)kJ?mol-1 |
| C、-(b+c-a)kJ?mol-1 |
| D、-(a-b-c)kJ?mol-1 |
| 1 |
| 2 |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中Ca2+数目增多 |
| B、溶液中Ca2+数目不变 |
| C、c(Ca2+)增大 |
| D、c(Ca2+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
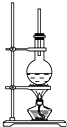 如图为硬脂酸甘油酯在碱性条件下水解的装置图.进行皂化反应的步骤如下:
如图为硬脂酸甘油酯在碱性条件下水解的装置图.进行皂化反应的步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的CH4参加反应,反应①②转移的电子数相同 |
| B、CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-530 kJ/mol |
| C、0.2mol CH4还原NO2至N2,且生成H2O(g)放出的热量为164.6 kJ |
| D、若用4.48L(标准状况)CH4还原NO2至N2且生成H2O(g),整个过程中转移电子1.60mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质及其杂质 | 检验 | 除杂 |
| A.Cl2(HCl) | 干燥的淀粉KI试纸 | 饱和食盐水 |
| B.NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
| C.CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D.NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑥ | B、①③⑤⑦ |
| C、②④⑥⑦ | D、①②④⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com