
����Ŀ��±��Ԫ�صĵ��ʺͻ�����ܶ࣬���ǿ���������ѧ���ʽṹ�����ʵ����֪ʶȥ��ʶ���������ǣ�
��1���ڲ�̫ϡ����Һ�У���������Զ����ӵϣ�HF��2��ʽ���ڵģ�ʹ�������ӵϵ��������� ��
��2��������±��ṩ�ĵ�һ�����������жϣ����п������ɽ��ȶ��ĵ��������ӵ�±��ԭ���� ��
�� | �� | �� | �� | |
��һ�����ܣ�kJ/mol�� | 1681 | 1251 | 1140 | 1008 |
��3����֪�ߵ�����������ʽ����ѧʽ�ֱ�ΪH5IO6���ṹ����ͼ����HIO4 �� ǰ��Ϊ��Ԫ�ᣬ����ΪһԪ�ᣮ��Ƚ϶�������ǿ����H5IO6HIO4 �� �����������������=����
��4������ˮ�е��ܽ����ȻС�����ڵ⻯����Һ���ܽ��ȴ������������������Һ�з������з�ӦI��+I2=I3�� �� I3�����ӵ�����ԭ����Χ�Ҽ����ӶԶ���Ϊ �� ��KI3���Ƶģ�����CsICl2�ȣ���֪CsICl2���ȶ��������ֽ⣬���������ɾ����ܸ�������ʣ�����������ʽ������
A��CsICl2=CsCl+ICl B��CsICl2=CsI+Cl2
��5����֪CaF2������ܶ�Ϊ��g/cm3 �� NAΪ�����ӵ�������CaF2�����ı߳�Ϊa pm����CaF2����Է����������Ա�ʾΪ���ú�a��ʽ�ӱ�ʾ���� 
���𰸡�
��1�����
��2��I
��3����
��4��2��A
��5��![]()
���������⣺��1��HF����֮����������ʹ�������ӵϣ����Դ��ǣ������
��2.��±��Ԫ�ذ�����F��Cl��Br��I��AtԪ�أ�Ԫ�صĵ�һ������ԽС��Ԫ��ʧ��������Խǿ���õ�������Խ������Խ�����γ������ӣ����ݱ�������֪��±��Ԫ���е�һ��������С����IԪ�أ����Ԫ����ʧ�������ɼ������ӣ����Դ��ǣ�I��
��3.��H5IO6�� 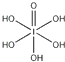 ���к���5���ǻ��⣬Ϊ��Ԫ�ᣬ�����ǻ���ԭ��1����HIO4ΪһԪ�ᣬ����2���ǻ��⣬�����ǻ���ԭ��2�����������ԣ�H5IO6��HIO4 �� ���Դ��ǣ�����
���к���5���ǻ��⣬Ϊ��Ԫ�ᣬ�����ǻ���ԭ��1����HIO4ΪһԪ�ᣬ����2���ǻ��⣬�����ǻ���ԭ��2�����������ԣ�H5IO6��HIO4 �� ���Դ��ǣ�����
��4.��I3�����ӵ�����ԭ����Χ�Ҽ����ӶԶ���Ϊ2�����Ӿ��������ӵ��Խ�࣬�뾶ԽС���Ӽ�Խǿ�����Ӿ���ľ�����Խ����֪��֪CsICl2���ȶ��������ֽ⣬���������ɾ����ܸ�������ʣ����Է����ķ�ӦΪCsICl2=CsCl+ICl�����Դ��ǣ�2��A��
��5.��CaF2������ͼ�� 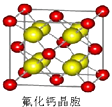 ������Caԭ����ĿΪ8��
������Caԭ����ĿΪ8�� ![]() +6��
+6�� ![]() =4��Fԭ����ĿΪ8��CaF2����Է�������ΪM����������m=
=4��Fԭ����ĿΪ8��CaF2����Է�������ΪM����������m= ![]() ���������V=a3 �� ���ݦ�V=
���������V=a3 �� ���ݦ�V= ![]() ������Է�������M=
������Է�������M= ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCO3��ɰ�ǻ��ÿ�������Ѫ����ʵ�������Ʊ�FeCO3��������ͼ��ʾ������˵��������ǣ� �� 
A.��ƷFeCO3�ڿ����и��·ֽ�ɵõ�������FeO
B.������KSCN��Һ����FeSO4��Һ�Ƿ����
C.������������CO2����ų�
D.��������Ƿ�ϴ�Ӹɾ����������ữ��BaCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�����е�Ƚϴ�����ǣ� ��
A.���飾���飾����
B.�����飾�����飾������
C.���������Ҷ������Ҵ�
D.�Զ��ױ����ڶ��ױ�������ױ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч����ij��ѧ�о�С���ͬѧ�ֱ��������ͼ�ס�����ʾ��ʵ�飮��ش�������⣺ 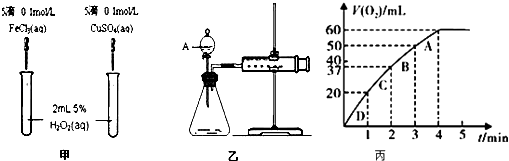
��1�����Է�������ͼ��ͨ���۲������ԱȽϵó����ۣ���ͬѧ�����CuSO4��ΪCuCl2��Ϊ�������������� ��
��2��������������ͼ����ʾ��ʵ��ʱ��������40mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԣ�ͼ������A������Ϊ �� ʵ������Ҫ������������ ��
��3������0.10mol MnO2��ĩ��50mL H2O2��Һ�У��ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ����ʾ�� ��ʵ��ʱ�ų�������������mL��
��A��B��C��D���㷴Ӧ���ʿ�����˳��Ϊ������ ��
�۽��ͷ�Ӧ���ʱ仯��ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaCl��Һ�л���Na2SO4��CaCl2��Һ�͵��۽��壬ѡ���ʵ����Լ��ͷ��������ᴿ��NaCl���壮��Ӧ��ʵ�������ͼ��
��1��д������ʵ������������Լ���д��ѧʽ�����Լ������Լ��� ��
��2���ж��Լ����ѹ����ķ����ǣ� ��
��3���û�ѧ����ʽ��ʾ�����Լ��ڵ����ã�
��4�������������ð�Ĥ���з����ᴿ�������ٵ�ʵ��������������ܡ����ܡ�������Ĥ��SO ![]() ����ܡ����ܡ�������Ĥ������ʵ��֤���������������±����ɲ�������Ҳ�����ӣ�����ѡ�Լ���1mol/L AgNO3��Һ��1mol/L BaCl2��Һ��1mol/L Ba��NO3��2��Һ����ˮ��ϡ���ᡢϡ����
����ܡ����ܡ�������Ĥ������ʵ��֤���������������±����ɲ�������Ҳ�����ӣ�����ѡ�Լ���1mol/L AgNO3��Һ��1mol/L BaCl2��Һ��1mol/L Ba��NO3��2��Һ����ˮ��ϡ���ᡢϡ����
��� | ʵ����� | Ԥ������ͽ��� |
�� |
|
|
�� |
|
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����﮵�ص����С�������������dz��õ�һ�ε�أ��õ�ط�Ӧԭ����ͼ��ʾ�����е����LiClO4���ڻ���л��ܼ��У�Li+ͨ�������Ǩ����MnO2�����У�����LiMnO2 �� �ش��������⣺ 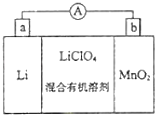
��1�����·�ĵ�������������������������ĸ����
��2�����������Ӧʽ ��
��3���Ƿ����ˮ�������еĻ���л��ܼ�������ǡ�����ԭ���� ��
��4��MnO2����KOH��KClO3�ڸ����·�Ӧ������K2MnO4 �� ��Ӧ�Ļ�ѧ����ʽΪ �� K2MnO4��������Һ���绯������KMnO4��MnO2�����ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪ����ȼ�ϵ�ص�ԭ��ʾ��ͼ�����մ�ͼ����ʾ��������������ȷ���ǣ� �� 
A.a�缫�Ǹ���
B.b�缫�ĵ缫��ӦΪ��4OH����4e���T2H2O+O2��
C.����ȼ�ϵ����һ�־���Ӧ��ǰ������ɫ��Դ
D.����ȼ�ϵ����һ�ֲ���Ҫ����ԭ����������ȫ�������ڵ���ڵ����ͷ���װ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��6���Ѷ��ᣨG���Ǻϳ���������Ҫԭ��֮һ�����ú�����̼ԭ�ӵ��л������������Ʊ�����ͼΪAͨ��������Ӧ�Ʊ�G�ķ�Ӧ���̣����ܵķ�Ӧ�м�����ΪB��C��D��E��F���� 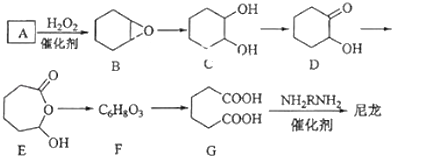
�ش��������⣺
��1��������A�к�̼87.8%������Ϊ�⣬A�Ļ�ѧ����Ϊ ��
��2��B��C�ķ�Ӧ����Ϊ ��
��3��F�Ľṹ��ʽΪ ��
��4���������м������У��˴Ź������׳��������� �� ���ٵ��� �� ���������ţ�
��5����G�ϳ������Ļ�ѧ����ʽΪ ��
��6����Aͨ��������Ӧ�Ʊ�1��3�����Ѷ�ϩ�ĺϳ�·��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��H����ѧ��ѧ�еij������ʣ�A��C��G�ǽ�����E��F�������B����ˮ����ɫ��Һ����������ͼ��ʾ�Ĺ�ϵ����Ӧ�����ɵ�ˮ����ȥ�����Իش��������⣮ 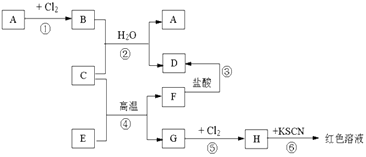
��1���ƶ���д���ʻ�ѧʽ��A�� �� D�� �� H��
��2����Ӧ�ܵĻ�ѧ����ʽΪ ��
��3���ý���C�Ʊ���һ�ֽ��������ǹ�ҵ�Ͻϳ��õķ������磺2C+4BaO ![]() 3Ba��+BaOC2O3
3Ba��+BaOC2O3
�ٳ�����C�Ľ����Ա�Ba�Ľ�������ѡ�ǿ������������
������������������ȡBa����Ҫԭ���� ��
a������ʱC�Ļ����Դ���Ba
b������������BaO�ֽ�
c������ʱBaOC2O3��C2O3�ȶ�
d������Ba�ķе�Ƚ���C�ĵ�
��4��Hˮ��Һ������ᷴӦʱ��������ɫ���ʣ��÷�Ӧ�����ӷ���ʽΪ
��5����51.2�˵�AͶ��200������������Һ��ǡ�÷�Ӧ��ȫ��������״���µ�NO2��NO��31.36L���������Ũ��molL��1 ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com