
 +2NaOH $\stackrel{△}{→}$
+2NaOH $\stackrel{△}{→}$  +H2O.
+H2O. 是一种重要的有机合成中间体.
是一种重要的有机合成中间体. ;②光照时,甲苯与Cl2侧链取代.
;②光照时,甲苯与Cl2侧链取代.分析 (1)A的分子式为C2H4O,含有发生有机反应,含有醛基,催化氧化得到乙酸,则A为CH3CHO;
(2)由B的结构简式可知,含有的官能团为羧基、羟基,B与甲醇发生酯化反应生成C为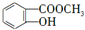 ;
;
(3)D中苯环与氢气发生加成反应;
(4)E中酯基所得得到的羧基、酚羟基均与氢氧化钠反应;
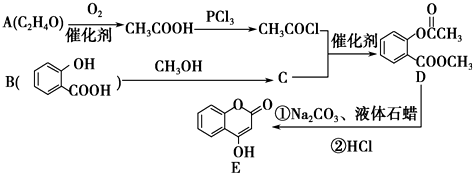
(5)同时满足下列条件的B的同分异构体:①能发生银镜反应,说明含有醛基;②遇FeCl3发生显色反应,说明含有酚羟基; ③1mol该物质最多可消耗2mol NaOH,结合B的结构简式可知,含有2个-OH、1个-CHO,④核磁共振氢谱显示其只有4种不同环境的氢原子,三个侧链处于间位,或邻位且-CHO处于2个-OH之间;
(6)甲苯与氯气在光照条件下得到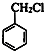 ,在氢氧化钠水溶液、加热条件下水解得到
,在氢氧化钠水溶液、加热条件下水解得到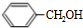 ,甲苯被酸性高锰酸钾溶液氧化得到
,甲苯被酸性高锰酸钾溶液氧化得到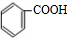 ,苯甲酸与苯甲醇在浓硫酸、加热条件下发生转化反应得到苯甲酸苯甲酯.
,苯甲酸与苯甲醇在浓硫酸、加热条件下发生转化反应得到苯甲酸苯甲酯.
解答 解:A的分子式为C2H4O,含有发生有机反应,含有醛基,催化氧化得到乙酸,则A为CH3CHO,乙酸分子羧酸中-OH被-Cl取代生成CH3COCl,B与甲醇发生酯化反应生成C为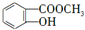 ,C与CH3COCl发生取代反应生成D,D转化得到E.
,C与CH3COCl发生取代反应生成D,D转化得到E.
(1)A为CH3CHO,发生银镜反应的化学方程式为:CH3CHO+2Ag(NH3)2OH $\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2Ag(NH3)2OH $\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O;
(2)B中含氧官能团为:羧基、羟基,B与甲醇发生酯化反应生成C为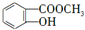 ,属于取代反应,
,属于取代反应,
故答案为:羧基、羟基;取代反应;
(3)D中苯环与氢气发生加成反应,1mol D最多可与3mol H2加成,
故答案为:3;
(4)E与足量NaOH溶液完全反应的化学方程式: +2NaOH $\stackrel{△}{→}$
+2NaOH $\stackrel{△}{→}$  +H2O,
+H2O,
故答案为: +2NaOH $\stackrel{△}{→}$
+2NaOH $\stackrel{△}{→}$  +H2O;
+H2O;
(5)同时满足下列条件的B的同分异构体:①能发生银镜反应,说明含有醛基;②遇FeCl3发生显色反应,说明含有酚羟基; ③1mol该物质最多可消耗2mol NaOH,结合B的结构简式可知,含有2个-OH、1个-CHO,④核磁共振氢谱显示其只有4种不同环境的氢原子,为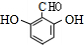 、
、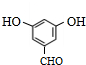 ,
,
故答案为:2;
(6)甲苯与氯气在光照条件下得到 ,在氢氧化钠水溶液、加热条件下水解得到
,在氢氧化钠水溶液、加热条件下水解得到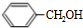 ,甲苯被酸性高锰酸钾溶液氧化得到
,甲苯被酸性高锰酸钾溶液氧化得到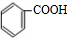 ,苯甲酸与苯甲醇在浓硫酸、加热条件下发生转化反应得到苯甲酸苯甲酯,合成路线流程图为:
,苯甲酸与苯甲醇在浓硫酸、加热条件下发生转化反应得到苯甲酸苯甲酯,合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成、官能团结构与性质、性质条件同分异构体书写等,注意掌握有机物官能团的性质和转化,结合反应条件与有机物结构进行分析,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 甲、乙提高相同温度 | B. | 甲中加入1molHe,乙不变 | ||
| C. | 甲降低温度,乙不变 | D. | 甲增加1molH2,乙增加1molI2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应一定是氧化还原反应 | B. | 非金属氧化物一定是酸性氧化物 | ||
| C. | 金属氧化物一定是碱性氧化物 | D. | 碱性氧化物一定是金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
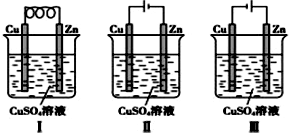
| A. | Ⅰ是原电池,Ⅱ是电镀装置 | |
| B. | Ⅰ、Ⅱ装置中锌极上均发生氧化反应 | |
| C. | Ⅱ、Ⅲ装置中,铜极均发生氧化反应而溶解 | |
| D. | Ⅱ、Ⅲ装置中Cu2+浓度基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe在少量Cl2中燃烧生成FeCl2 | |
| B. | 石油的裂解、煤的干馏都是化学变化 | |
| C. | 化学反应的焓变与反应的途径有关 | |
| D. | 等质量的铜按a、b两种途径完全转化为硝酸铜,途径a、b消耗的硝酸一样多 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2;途径b:Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,Mo3S4发生氧化反应 | |
| B. | 放电时,负极反应式:Mo3S4+2xe-→Mo3S42x- | |
| C. | 充电时,Mg2+向阴极迁移 | |
| D. | 充电时,阳极反应式:xMg2++2xe-→xMg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+与SO42-的物质的量浓度之比为2:3 | |
| B. | 1L溶液中SO42-的物质的量为1.5mol | |
| C. | 准确称取17.1g的Al2(SO4)3用100 mL蒸馏水溶解可配制得到该浓度的溶液 | |
| D. | 从1L 0.5 mol•L-1Al2(SO4)3溶液中取出100mL,Al3+浓度仍为1 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com