
| A. | 熔沸点:S<NaCl<SiO2 | |
| B. | 酸性:HNO2<HNO3;H3PO4<H2SO4 | |
| C. | 键角:H2O中H-O-H<NH3中H-N-H<CH4中H-C-H | |
| D. | 键长:C-H<O-H |
分析 A.熔点一般为原子晶体>离子晶体>金属晶体>分子晶体;
B.HNO2是弱酸,而HNO3是强酸;元素的非金属性越强,最高价含氧酸的酸性越强;
C.CH4中,C-H键间的键角为109°28′,NH3中N-H键间的键角为107°.H2O中O-H键间的键角为105°;
D.键长指成键原子的核间距,原子半径越大,键长越长.
解答 解:A.SiO2为原子晶体,NaCl为离子晶体,S为分子晶体,熔点一般为原子晶体>离子晶体>金属晶体>分子晶体,故A正确;
B.HNO2是弱酸,而HNO3是强酸;非金属性S>P,元素的非金属性越强,最高价含氧酸的酸性越强,故B正确;
C.CH4中,C-H键间的键角为109°28′,NH3中N-H键间的键角为107°.H2O中O-H键间的键角为105°,则键角:H2O中H-O-H<NH3中H-N-H<CH4中H-C-H,故C正确;
D.同一周期,从左往右,原子半径逐渐减小,故原子半径:C>O,故键长:C-H>O-H,故D错误.
故选D.
点评 本题考查元素周期律知识,为高频考点,侧重于学生的分析能力和基本概念的理解和运用的考查,注意把握物质的性质的比较角度以及元素周期率的运用,难度中等.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:解答题

| 化学键 | H-H | C-H | C-C | C=C |
| 键能(kJ•mol-1) | 436 | 413 | 348 | 612 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
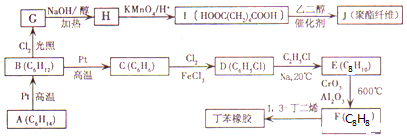
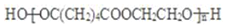 .
.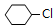 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$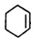 +NaCl+H2O.
+NaCl+H2O.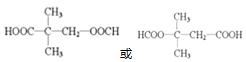 (写出其中一种的结构简式).
(写出其中一种的结构简式). .
.查看答案和解析>>
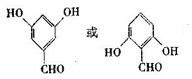
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有羟基的有机物称为醇 | B. | 能发生银镜反应的有机物都是醛 | ||
| C. | 苯酚俗称石炭酸,酸性比碳酸强 | D. | C3H6和C4H8不一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
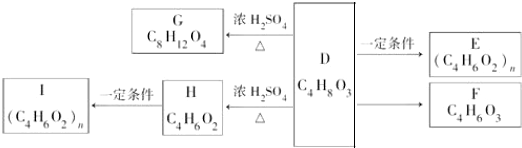
 .
.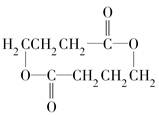 +2H2O.
+2H2O.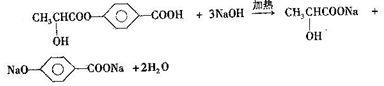 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该反应的正反应放热 | |
| B. | 达到平衡时,容器I中反应物转化率比容器Ⅱ中的小 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的正反应速率比容器I中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1mol/L NaHSO3溶液中含有HSO3-离子数为0.1NA | |
| B. | 50 mL 18.4 mol•L-1浓硫酸与足量铜反应,生成SO2分子数为0.46 NA | |
| C. | 1 mol H2和1 mol I2充分反应,可得到HI分子数为2NA | |
| D. | 2.2 g CO2与足量镁粉反应,转移电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com