
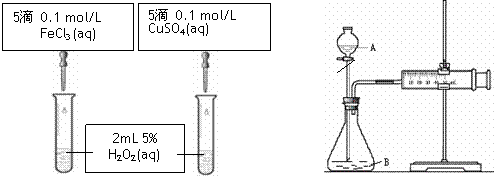
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
丙
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,检查该装置气密性的方法是
,实验中需要测量的数据是 。
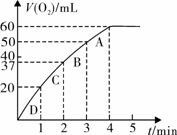
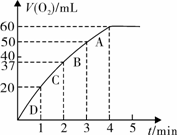
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示
① 写出H2O2在MnO2作用下发生反应的化学方程式 。
②计算H2O2的初始物质的量浓度_____________。 (请保留两位有效数字)
(1)产生气泡的快慢 消除阴离子不同对实验对干扰
(2)分液漏斗 关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位 产生40ml气体所需的时间
(3)2H2O22H2O+O2↑ 0.11 mol/L
解析:(1)考查外界条件对反应速率的影响。双氧水分解生成氧气,所以可以通过观察气泡产生的快慢来比较催化效果。因为氯化铁和硫酸铜的阴离子不同,所以为排除阴离子的干扰,用硫酸铁比较合理。
(2)A是分液漏斗。因为右侧是带有活塞的针筒,所以检查该装置气密性的方法是关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位。要比较反应快慢,就需要测量收集等量气体是所需的时间。
(3)根据图像可知50 m LH2O2共产生标准状况下氧气60ml,其物质的量为
 0.0027mol,根据方程式可知消耗双氧水0.0054mol,所以其浓度约为
0.0027mol,根据方程式可知消耗双氧水0.0054mol,所以其浓度约为
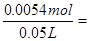 0.11mol/L。
0.11mol/L。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| l | 3+ |
| g | 2+ |
| a | 2+ |
| e | 3+ |
| O | - 3 |
| O | 2- 3 |
| O | 2- 3 |
| O | 2- 4 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省山大附中高一下学期期末考试化学试卷(带解析) 题型:实验题
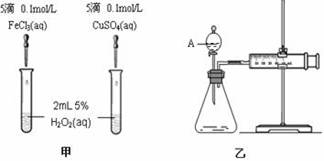
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: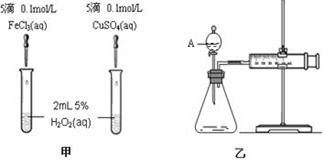
(1)定性分析:如图甲可通过观察 现象,定性比较得出结论。有同学提出将Cu SO4改为CuCl2更为合理,其理由是 ,
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的数据是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
①实验时放出气体的总体积是 mL。
②A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
③解释反应速率变化的原因 。
查看答案和解析>>
科目:高中化学 来源:2014届山西省高一下学期期末考试化学试卷(解析版) 题型:实验题
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察 现象,定性比较得出结论。有同学提出将Cu SO4改为CuCl2更为合理,其理由是 ,
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的数据是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
①实验时放出气体的总体积是 mL。
②A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
③解释反应速率变化的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为比较Fe3+和Cu2+对H2O2分解的催化效果,甲、乙同学分别设计了如图一、图二所示的实验。
(1) H2O2分解的化学方程式为 。
 |
图一 图二
(2)图一所示实验能定性说明反应快慢的依据是 _______________________________;
图二所示实验能说明反应快慢的数据是____________________________________。
(3)① 用H2O2和H2SO4的混合溶液可溶解印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H= + 64.39 kJ/mol
2H2O2(l)=2H2O(l) + O2(g) △H= ﹣196. 46 kJ/mol
H2(g) + 1/2O2(g) = H2O(l) △H= ﹣285. 84 kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+ 和H2O的热化学方程式为:
。
② 控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3 .0 mol/L H2SO4的混
合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 (×10—3 mol·L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因
是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com