
| (1) | 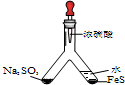 | 实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为管壁内有淡黄色固体生成;硫化亚铁处加水的目的是稀释浓硫酸,防止硫化氢被氧化. |
| (2) | 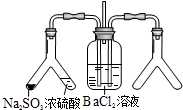 | 实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y型管中应放置的药品是浓氨水、碱石灰(固体NaOH、生石灰)(必要时可以加热),该沉淀的化学式为BaSO3. |
| (3) | 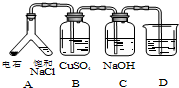 | 实验目的:探究电石气中的成分 ①装置A中的化学反应方程式为: CaC2+2H2O→Ca(OH)2+CH≡CH↑. ②B装置中出现黑色沉淀,可判断电石气中含有H2S;C装置的作用为除去硫化氢. ③为验证电石气的主要成分,D中盛放酸性高锰酸钾溶液或溴水. |
| (4) | 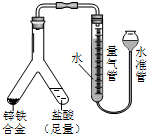 | 实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是抬高(或移动)水准管位置,使水准管、量气管内液面相平 ②若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的含量为69.14%(保留2位小数,已折算标况). |
分析 (1)硫酸和亚硫酸钠反应生成二氧化硫,稀硫酸和FeS反应生成硫化氢,如果二氧化硫和硫化氢反应且二氧化硫体现氧化性,则二者应该生成S,浓硫酸能氧化硫化氢;
(2)SO2与BaCl2反应产生沉淀,溶液中必须存在大量的SO32-;
(3)碳化钙和水反应生成氢氧化钙和乙炔,硫化氢和硫酸铜反应生成黑色的CuS;
验证乙炔可以利用高锰酸钾溶液被还原褪色,或和溴水发生加成反应溴水褪色证明;
(4)①读取量气管中数据时,为减小误差,应使水准管、量气管内液面相平;
②假设合金中Fe为xmol,Zn为ymol,列方程式组可解答该题.
解答 解:(1)加入硫酸分别生成SO2和H2S,二者可发生反应生成S,为淡黄色固体,H2S具有强还原性,则二氧化硫体现氧化性,硫化氢可与浓硫酸发生氧化还原反应,所以与有FeS的一侧应用水稀释,
故答案为:管壁内有淡黄色固体生成;稀释浓硫酸,防止硫化氢被氧化;
(2)SO2与BaCl2反应产生沉淀,溶液中必须存在大量的SO32-,右侧Y型管中应能生成碱性气体或氧化性气体,如是碱性气体,溶液中存在大量的SO32-,如是氧化性气体,溶液中可生成SO42-,则生成的沉淀可能为BaSO3或BaSO4,如果是碱性气体氨气,可以用浓氨水、碱石灰(固体NaOH、生石灰)制取,生成的沉淀是BaSO3,
故答案为:浓氨水、碱石灰(固体 NaOH、生石灰);BaSO3;
(3)①碳化钙和水反应生成氢氧化钙和乙炔,反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:CaC2+2H2O→Ca(OH)2+CH≡CH↑;
②硫化氢和硫酸铜反应生成黑色的CuS,实验中生成黑色沉淀,说明含有H2S,硫化氢是酸性气体,则可以用碱液除去,如NaOH溶液,所以C装置作用是除去硫化氢,
故答案为:H2S;除去硫化氢;
③验证乙炔可以利用高锰酸钾溶液被还原褪色,或和溴水发生加成反应溴水褪色证明,
为验证电石气的主要成分,D中盛放的试剂可以是高锰酸钾溶液或溴水,验证乙炔可以利用高锰酸钾溶液被还原褪色,或和溴水发生加成反应溴水褪色证明;
故答案为:高锰酸钾溶液或溴水;
(4)①读取量气管中数据时,为减小误差,应使水准管、量气管内液面相平,
故答案为:抬高(或移动)水准管位置,使水准管、量气管内液面相平;
②设合金中Fe为xmol,Zn为ymol,则有 56x+65y=0.117 x+y=$\frac{0.0448L}{22.4L/mol}$=0.002mol
解之得:x=0.001444,y=0.000556,
则合金中铁的含量为$\frac{0.001444×56}{0.117}$=69.14%,
故答案为:69.14.
点评 本题考查性质实验方案设计及实验基本操作,为高频考点,侧重考查学生实验操作、实验观察分析及计算能力,明确实验原理、物质性质、各个物理量之间的关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 100℃时,pH=12的NaOH(aq)和pH=2的H2SO4(aq)恰好中和,所得溶液的pH=7 | |
| B. | 100℃时,0.2 mol/L Ba(OH)2(aq)和0.2 mol/L HCl(aq)等体积混合,所得溶液的pH=7 | |
| C. | 25℃时,0.2 mol/L NaOH(aq)与0.2 mol/L CH3COOH(aq)恰好中和,所得溶液的pH=7 | |
| D. | 25℃时,pH=12的氨水和pH=2的H2SO4(aq)等体积混合,所得溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
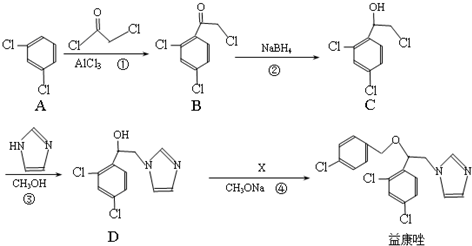
 .
. .
.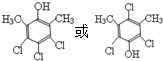 .
. 和
和  为原料制备
为原料制备 的合成路线流程图(乙醇和无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(乙醇和无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上海属“水质性缺水”,保护水资源刻不容缓 | |
| B. | 提倡节水产业,加强废水处理 | |
| C. | 只喝桶装水或功能性饮料以保证饮用水质量 | |
| D. | 用再生水灌溉城市绿地 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钙溶于稀硝酸:CO32-+2H+→CO2↑+H2O | |
| B. | 氯化铜溶液中加入NaHS溶液:Cu2++HS-=CuS↓+H+ | |
| C. | 碳酸钠溶液中通入少量二氧化碳:CO32-+CO2+H2O=2HCO3- | |
| D. | 硫酸氢铵溶液中加入少量氢氧化钠溶液:NH4++OH-→NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难失去电子的原子,易形成阴离子 | |
| B. | 只有化合物分子中才存在共价键 | |
| C. | 共价分子中所有原子都具有8电子稳定结构 | |
| D. | 含氧酸的组成中可以含有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
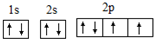 ;氧元素原子核外有3种不同能级的电子;
;氧元素原子核外有3种不同能级的电子;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{W}{m+n+2}$×m mol | B. | $\frac{W}{m+n}$×m mol | C. | $\frac{W}{m+n+2}$×(m+2)mol | D. | $\frac{W}{m+n}$×(m-2)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠保存在煤油中 | |
| B. | 烧碱溶液盛装在带有玻璃塞的试剂瓶中 | |
| C. | 含有Fe3+的盐溶液遇KSCN 溶液变红 | |
| D. | 明矾(KAl(SO4)2•12H2O)可用作净水剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com