
【题目】化合物PH4I是一种白色晶体,受热不稳定,易分解产生PH3。PH3是无色剧毒气体, 广泛用于半导体器件和集成电路生产的外延、离子注入和掺杂。
(1)在2L真空密闭容器中加入一定量PH4I固体,T1℃ 时发生如下反应: PH4I(s) PH3(g) + HI(g)
①下列可以作为反应达到平衡的判据是_____。
A.容器内气体的压强不变
B.容器内 HI 的气体体积分数不变
C.容器内 PH4I 质量不变
D.容器内气体的密度不变
E.容器内气体的平均相对分子质量不变
②t1时刻反应达到平衡后,在t2时刻维持温度不变瞬间缩小容器体积至1L,t3时刻反应重新达到 平衡。在下图中画出t2~t4 时段的υ正、υ逆随时间变化图______。
(2)PH4I固体分解产生的PH3和HI均不稳定,在一定温度下也开始分解。在2L真空密闭容器中加 入一定量PH4I固体,已知在T2℃ 时存在如下反应:
Ⅰ PH4I(s) PH3(g) + HI(g) ΔH1
Ⅱ 4 PH3(g) P4(g) + 6 H2(g) ΔH2
Ⅲ 2 HI(g) H2 (g) + I2(g) ΔH3
①已知:298K,101kPa,H-P键、P-P键、H-H键的键能分别为322 kJ·mol-1、200 kJ·mol-1、436 kJ·mol-1试计算ΔH2 =______________。
②各反应均达平衡时,测得体系中 n(PH3)=a mol ,n(P4)=b mol ,n(H2)=c mol ,则 T2℃时 反应I的平衡常数K值为___________________。(用a、b、c表示)
③维持温度不变,缩小体积增大压强,达到新的平衡后,发现其它各成分的物质的量均发生变化,而n(I2)基本不变,试解释可能原因_____。
【答案】ACD 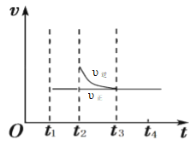 +48kJ·mol-1
+48kJ·mol-1 ![]() 增大压强的瞬间各气体浓度均增大,反应I平衡逆向移动使c(HI)减小,反应II平衡逆向移动使c(H2)减小,对于反应III两者作用相当,反应III平衡不移动,n(I2)基本不变(只答反应III平衡不移动不得分)
增大压强的瞬间各气体浓度均增大,反应I平衡逆向移动使c(HI)减小,反应II平衡逆向移动使c(H2)减小,对于反应III两者作用相当,反应III平衡不移动,n(I2)基本不变(只答反应III平衡不移动不得分)
【解析】
结合条件是否为变量判断能否作为达到平衡的标志,根据外因对平衡移动的影响作图,根据ΔH=反应物的总键能-生成物的总键能计算ΔH2,利用三段式计算平衡常数。
(1)①A.反应前没有气体,反应后生成气体,反应中容器内气体压强一直改变,当容器内气体压强不再改变时,可以说明反应达到平衡状态,A符合;
B.根据反应式可知,容器内HI的气体体积分数始终不变,容器内HI的气体体积分数不变不能作为反应达到平衡的标志,B不符合;
C.容器内PH4I的质量不再改变时,可以说明反应达到平衡状态,C符合;
D.容器体积始终不变,气体总质量发生改变,则容器内气体的密度不再改变时,可以说明反应达到平衡,D符合;
E.容器内气体的平均相对分子质量始终不变,容器内气体的平均相对分子质量不变不能作为反应达到平衡的标志,E不符合;
故答案选ACD;
②t1时刻反应达到平衡后,在t2时刻维持温度不变瞬间缩小容器体积至1L,则平衡逆向移动,υ逆>υ正,但由于PH4I为固体,增大压强,正反应速率不变,t3时刻反应重新达到平衡,υ正=υ逆,因此t2~t4时段的υ正、υ逆随时间变化图为: ;
;
(2)①根据ΔH=反应物的总键能-生成物的总键能,ΔH2=(4×3×322 kJ·mol-1)-[(6×200 kJ·mol-1)+(6×436 kJ·mol-1)]=+48kJ·mol-1;
②各反应均达平衡时,测得体系中n(PH3)=a mol,n(P4)=b mol,n(H2)=c mol,根据白磷为bmol,结合反应Ⅱ计算可知,消耗的PH3为4bmol和生成的H2为6bmol,因为最终PH3为amol,说明反应Ⅰ生成的PH3和HI都为(a+4b)mol,最终氢气为cmol,则反应Ⅲ生成H2为(c-6b)mol,反应Ⅲ消耗HI为(2c-12b)mol,则平衡时HI为(a+4b-2c+12b)=(a+16b-2c)mol,T2℃时,对于反应Ⅰ的平衡常数为![]() ;
;
③由于增大压强的瞬间各气体浓度均增大,而反应I平衡逆向移动使得c(HI)减小,反应II平衡逆向移动使c(H2)减小,对于反应III两者作用相当,反应III平衡不移动,因此n(I2)基本不变。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】电子工业中,人们常用FeCl3溶液腐蚀覆铜板来制作印刷电路板,并回收Cu和综合利用FeCl3溶液。实验室模拟流程如图所示:
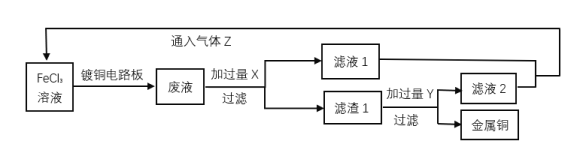
回答下列问题:
(1)过滤操作除铁架台(附铁圈)、烧杯、滤纸外还需要的仪器为___。
(2)滤渣1成分的化学式为___;试剂Y为___。
(3)可替代气体Z的试剂为___(填序号)
A.硝酸 B.酸性高锰酸钾 C.过氧化氢
(4)写出FeCl3溶液腐蚀覆铜板的离子方程式___。
(5)用实验证明滤液1中只含有Fe2+___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学们分别设计了如图甲、乙所示的实验装置。请回答相关问题:

(1)定性甲所示装置可通过观察___,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___。
(2)定量如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为___,实验中需要测量的数据是___。
Ⅱ.以下是某研究小组探究影响反应速率部分因素的相关实验数据。
实验序号 | H2O2溶液浓度/% | H2O2溶液体积/mL | 温度/℃ | MnO2的用量/g | 收集O2的体积/mL | 反应所需时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 2 | 49.21 | |
④ | 30 | 5 | 55 | 2 | 10.76 |
(1)写出实验①中H2O2分解的化学方程式___。
(2)通过实验①和②对比可知,化学反应速率与____有关;从实验③和④对比可知,化学反应速率与温度的关系是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是 ( )

A. OH—+HCl=H2O+C1—
B. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C. Fe+CuCl2=Cu+FeCl2
D. Fe+2H+=Fe2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
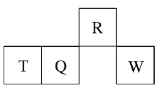
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 单质T与NaOH溶液不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量 (g/100mL )。
I.实验步骤:
(1)用_____ (填仪器名称 )量取10.00mL 食用白醋,在_____ (填仪器名称 )中用水稀释后转移到100mL_____ (填仪器名称 )中定容,摇匀即得待测白醋溶液。
(2)用_____色手柄滴定管取待测白醋溶液 20.00mL 于锥形瓶中,向其中滴加2滴_____作为指示剂。
(3)读取盛装0.1000mol/L NaOH 溶液的滴定管的初始读数。如果液面位置如图所示 则此时的读数为_____mL。
![]()
(4)滴定。当_____时,停止滴定,并记录 NaOH溶液的终读数,重复滴定 3 次。
II.实验记录
滴定次数 实验数据 (mL ) | 1 | 2 | 3 | 4 |
V (样品 ) | 20.00 | 20.00 | 20.00 | 20.00 |
V (NaOH ) (消耗 ) | 15.95 | 15.00 | 15.05 | 14.95 |
(5)甲同学在处理数据时计算得平均消耗的NaOH溶液的体积为:V= (15.95+15.00+15.05+14.95 )/4=15.24(mL)。指出他的计算的不合理之处:_____。 按正确数据处理,可得c (市售白醋)=_____mol/L。
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是_____ (填写序号)
a.盛装NaOH的滴定管在滴定时未用标准NaOH溶液润洗
b.盛装待测白醋的滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烃 的说法正确的是
的说法正确的是
A. 共面的C原子最多为14个
B. 共直线的C原子只有为4个
C. 1mol该烃最多可以和6molH2发生加成反应
D. 1mol该烃最多可以消耗6molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一稀酸对Fe﹣Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )

A.稀硝酸对Fe﹣Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)═Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe﹣Cr合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对Fe﹣Cr合金的腐蚀性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1mol H2O2放出热量98kJ,在含少量I-的溶液中,H2O2分解的机理为:
H2O2+I-→H2O+IO- 慢
H2O2+IO-→H2O+O2+I- 快
下列有关该反应的说法正确的是( )
A.反应速率与I-浓度无关
B.IO-也是该反应的催化剂
C.分解2mol H2O2放出热量196kJ
D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com