
����Ŀ��ijͬѧΪ��֤Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ�������ͼװ�ÿ���֤ͬ����ǽ����Եı仯���ɣ����������ϵ��ʵ�飮 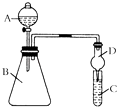
��1����Na2S��Һ��ͨ���������ֵ���ɫ���ǣ���֤��Cl�ķǽ����Ա�Sǿ����Ӧ�����ӷ���ʽΪ ��
��2������A������Ϊ ��
��3����Ҫ֤���ǽ����ԣ�Cl��I����A�м�Ũ���ᣬB�м�KMnO4 �� ��KMnO4��Ũ���᳣���·�Ӧ������������C�мӵ��۵⻯�ػ����Һ���۲쵽�����Һ��������֤�����ӻ��������Ĺ۵㿼�ǣ���װ��ȱ��β������װ�ã�������Һ����β����
��4����Ҫ֤���ǽ����ԣ�C��Si������A�м����ᡢB�м�CaCO3 �� C�м�Na2SiO3��Һ�۲쵽C����Һ��������֤�������е�ͬѧ��Ϊ������лӷ��ԣ�Ӧ����Һ��ȥ��
���𰸡�
��1��S2��+Cl2�TS��+2Cl��
��2����Һ©��
��3��������NaOH
��4���а�ɫ�������ɣ�����NaHCO3
���������⣺��1������������ǿ�����ʣ����������ܹ��������ӷ�Ӧ������Ӧ�����ӷ���ʽΪ��S2��+Cl2�TS��+2Cl�� �� ���Դ��ǣ�S2��+Cl2�TS��+2Cl������2������A������Ϊ��Һ©�������Դ��ǣ���Һ©������3��KMnO4��Ũ���ᷴӦ������������������۵⻯�ػ����Һ��Ӧ���ɵⵥ�ʣ���Ӧ���ӷ���ʽΪ��2I��+Cl2�TI2+2Cl�� �� ����������Һ����ɫ����C����Һ��Ϊ��ɫ����������������ɢ�������У���Ⱦ����������NaOH��Һ���գ���Ӧ���ӷ���ʽΪ��2OH��+Cl2�TCl��+ClO��+H2O�����Դ��ǣ�������NaOH����4����̼��ȹ���ǿ��������̼��������Ʒ�Ӧ���ɹ����������Һ����ǣ��Ȼ�����лӷ��ԣ�����ʵ��������Ҫ��������̼�е��Ȼ�������������Ȼ�����̼�����Ʒ�Ӧ����������̼����Ӧ��������B��C֮������װ�б���NaHCO3��Һ��ϴ��ƿ�����Դ��ǣ��а�ɫ�������ɣ�����NaHCO3 ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȷ��ȡ25.00 mL���Ը��������Һ����ѡ�õ�������(����)
A.500 mL��ͲB.10 mL��ͲC.50 mL��ʽ�ζ���D.50 mL��ʽ�ζ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������NH4HCO3��NaHSO3�Ļ���ij��ȤС��Ϊ�ⶨ����NH4HCO3�ĺ�������������ڻ�����м����ʵ�鷽�����ⶨ������������ (��֪����KMnO4��SO2��ԭ�ķ�Ӧԭ����SO2��MnO4-��H2O��SO42-��Mn2����H��)�ش��������⣺
��1����ѧС����Ҫѡ��������ҩƷ����������ʵ�顣(ͼ��ÿ������װ��ֻѡ����һ�Σ�����̨�ȹ̶�����δ����)
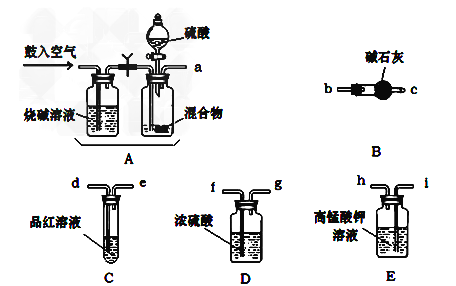
��1���밴�����������ҵķ�����������˳����(�������Ľӿ���ĸa��b��)
a����_________________________________________��
��2��ʵ������п����Ĺ�����Ҫ��2�Σ���һ�ι��������������_______________��
��3��Cװ�õ�������_________________��
��4�����������Ʒ����Ϊ13.1g��������ú��ʯ������4.4g����������NH4HCO3����������Ϊ____________��
��5���Ӷ����ⶨ��ȷ�Կ��ǣ�����װ�û�Ӧ����һ���ĸĽ���_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������д������
A. ����ʱ��Ӧ��������ƿ�м��뼸�����Ƭ����ֹ����
B. ��������ʱ��Ӧʹ������е�ˮ����ȫ���ɺ���ֹͣ����
C. ����ʱ��Ӧʹ�¶ȼ�ˮ����������ƿ֧�ܿڴ�
D. ����ʱ��Ҫ�������˵�Һ���ز���������©����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�������ڱ��е�λ�ã���ӳ��Ԫ�ص�ԭ�ӽṹ��Ԫ�ص����ʣ���ͼ��Ԫ�����ڱ���һ���֣� 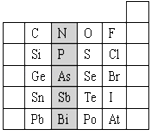
��1����Ӱ����Ԫ��N��Ԫ�����ڱ��е�λ��Ϊ ��
����Ԫ�������ɣ�����Ԥ�⣺H3AsO4��H3PO4������ǿ����H3AsO4H3PO4 �� ���á���������������=����ʾ��
��2��Ԫ��S��������ۺ�����۷ֱ�Ϊ�� ��
��3����һ�������£�S��H2��Ӧ��һ���ȣ�������Ϊ��Ӧ���еij̶ȣ������ж�����ͬ������Se��H2��Ӧ���ȣ�ѡ���������С������ͬ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������м���������Ʒ�Ӧ�ų���������������������Һ��Ӧ���ǣ� ��
A. �Ҵ� B. �� C. �������� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����Ҫ�Ļ�����Ʒ��ijѧϰС����Ʒ����Ʊ������ᡣ��Ӧԭ�����£�
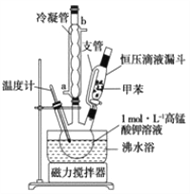
C6H5-CH3+2KMnO4 �� C6H5-COOK+KOH+2MnO2��+H2O
�ױ� �������
C6H5-COOK+HCl �� C6H5-COOH+KCl
������
��֪�ױ����۵�Ϊ��95�棬�е�Ϊ110.6�棬�ӷ����ܶ�Ϊ0.866 g��cm��3��
��������۵�Ϊ122.4�棬��25���95�����ܽ�ȷֱ�Ϊ0.3 g��6.9 g��
���Ʊ���Ʒ��30.0 mL�ױ���25.0 mL 1 mol��L��1
���������Һ��80���·�Ӧ30 min��װ����ͼ��ʾ��
��1�������ܵĽ�ˮ��Ϊ__________���a����b����
��2���ڱ�ʵ���У�������ƿ����ʵ��ݻ���________������ĸ��
A��50 mL B��100 mL C��200 mL D��250 mL
�������Ʒ����������������̷���ֲ�Ʒ������ͻ��ռױ���

��3���������������____�������ʵIJ��ᆳ�������һ���ᴿ����ɫҺ��A����������������_______��
��4���������������____������B���Ƿ���Cl���ķ������£�ȡ����B����ˮ�����ϲ���Һ�еμ�ϡ�����ữ��________��Һ����������ɫ��������B�к���Cl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӹ���Ϊ[Ar]3d84s2��Ԫ���ǣ� ��
A.ϡ������B.����Ԫ��C.����Ԫ��D.±��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A.����ˮ��Ӧ��Na+H2O�TNa++OH��+H2��
B.ϡ����������������Һ��Ӧ��SO ![]() +Ba2+�TBaSO4��
+Ba2+�TBaSO4��
C.�ð�ˮ��Һ�Ȼ���������Ag++2NH3?H2O�T[Ag��NH3��2]++2H20
D.Fe��OH��3 ���ڹ�����HI��Һ��2Fe��OH��3+6H++2I���T2Fe2++I2+6H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com