
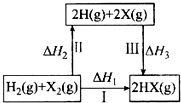
| A. | H2 (g)+X2(g)═2H(g)+2X(g)△H2<0 | |
| B. | 生成HX的反应热与途径有关,所以△H1≠△H2+△H3 | |
| C. | 若X分别表示Cl,Br,I,则过程Ⅱ吸收的热量依次增多 | |
| D. | Cl2,Br2分别发生反应I,同一温度下的平衡常数分别为K1,K2,则K1>K2 |
分析 A、化学键的断裂要吸热,焓变大于0;
B、依据盖斯定律分析,反应焓变与起始物质和终了物质有关于变化途径无关;
C、HCl、HBr、HI的化学键的键能逐渐减小;
D、根据化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差来判断
解答 解:A、化学键的断裂要吸热,焓变大于0,H2(g)+X2(g)═2H(g)+2X(g)△H2>0,故A错误;
B、反应焓变与起始物质和终了物质有关于变化途径无关,途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 ,故B错误;
C、途径III是断形成化学键的过程,是放热过程,Cl、Br、I的原子半径依次增大,故形成HCl、HBr、HI化学键所放出的能量逐渐减小,故C错误;
D、途径Ⅰ生成HCl放出的热量比生成HBr的多,氯气和氢气化合更容易,两反应的平衡常数分别为K1,K2,则K1>K2,故D正确;
故选D.
点评 本题考查了合成反应能量变化,反应焓变分析判断,物质结构和同主族性质变化规律是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Mg2+的结构示意图: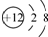 | |
| B. | 葡萄糖的结构简式:C6H12O6 | |
| C. | H2O2的电子式: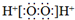 | |
| D. | 硫酸的电离方程式:H2SO4═H22++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有关物质的转化关系如图所示(部分物质和条件已略去).F是最简单的烃,B是最常见的无色液体,A是一种淡黄色固体,G是一种既能溶于强酸又能溶于强碱的白色固体,C由两种短周期元素组成,其摩尔质量为144g•mol-1.
有关物质的转化关系如图所示(部分物质和条件已略去).F是最简单的烃,B是最常见的无色液体,A是一种淡黄色固体,G是一种既能溶于强酸又能溶于强碱的白色固体,C由两种短周期元素组成,其摩尔质量为144g•mol-1. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时储氢合金作正极 | |
| B. | 充电时储氢合金作负极 | |
| C. | 充电时阳极周围c(OH-)减少 | |
| D. | 放电时负极反应为LaNi5H6-6e-═LaNi5+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
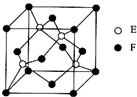 A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:
A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:| A | 原子半径最小的元素 |
| B | 原子核外电子有6种不同的运动状态 |
| D | 原子L电子层上有2对成对电子 |
| E | E与D同主族 |
| F | 基态F+核外有3层电子且各层均处于全满状态 |
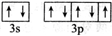 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
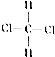 和
和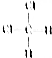 ⑧乙烷和戊烷
⑧乙烷和戊烷查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
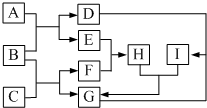
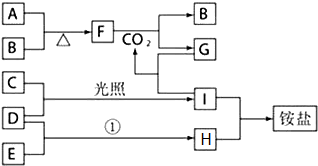 某兴趣小组的同学发现《高中化学(必修1)》中学习的单质及其化合物(或其溶液)存在如图的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;F为淡黄色粉末,化合物H和I通常状况下呈气体;反应①是化工生产中的一种重要固氮反应.
某兴趣小组的同学发现《高中化学(必修1)》中学习的单质及其化合物(或其溶液)存在如图的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;F为淡黄色粉末,化合物H和I通常状况下呈气体;反应①是化工生产中的一种重要固氮反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com