
液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是:

A.b极发生氧化反应
B.a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C.放电时,电流从a极经过负载流向b极
D.其中的离子交换膜需选用阳离子交换膜
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015湖南省娄底市高一上学期期末考试化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数,下列叙述正确的是
A.78g Na2O2与足量水充分反应时电子转移数为NA
B.25℃、101.3kPa时,11.2L H2中含有的原子数为NA
C.标况下1 mol SO3的体积约为22.4L
D.2L 1mol/L Na2SO4溶液中离子总数为3NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省清远市高三上学期期末理综化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数,下列说法正确的是
A.同温同压同体积的CO2和SO2所含氧原子数均为2NA
B.32gCu与S完全反应转移的电子数为NA(相对原子质量 Cu:64)
C.1L 1.0mol·L—1 NH4Cl与2L 0.5mol·L—1 NH4Cl溶液含NH4+数目相同
D.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH— 数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:填空题
【选修2—化学与技术】(14分)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:

(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。(1分)
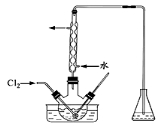
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
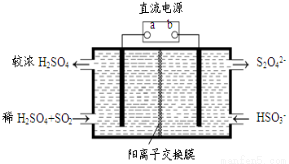
①阳极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
有一反应:2A+B 2C,其中A、B、C均为气体,右图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是:
2C,其中A、B、C均为气体,右图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是:
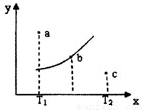
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D.c点可表示v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
元素周期表中短周期的一部分如图,关于X、Y、Z、W、Q说法正确的是:
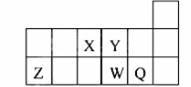
A.元素Y与元素Z的最高正化合价之和的数值等于9
B.原子半径的大小顺序为:W>Z>Y
C.离子半径的大小顺序为:W2->Y2->Z3+
D.W的气态氢化物的热稳定性和还原性均比Q强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:填空题
(16分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
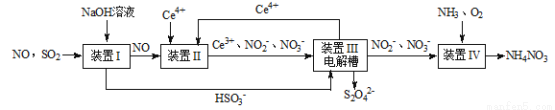
(1)装置Ⅰ中的主要离子方程式为 。
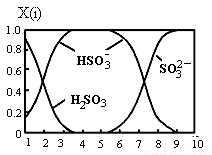 (2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。

①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下反应的离子方程 式 , 。
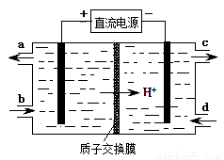
(4)装置Ⅲ还可以使Ce4+再生,其原理如图所示。①生成Ce4+从电解槽的 (填字母序号)口流出。②写出阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有下列离子中的几种(不考虑溶液中微量的H+和OH-):Na+、NH 、SO
、SO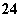 、CO
、CO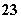 、NO
、NO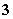 。取200 mL该溶液,等体积分成两份,分别做下列实验。
。取200 mL该溶液,等体积分成两份,分别做下列实验。
实验一:第一份加入足量烧碱并加热,产生的气体在标准状况下为224 mL。
实验二:第二份先加入足量的盐酸,无现象,再加入足量BaCl2溶液,得沉淀2.33 g。
A.该溶液可能含有Na+ B.该溶液一定含有NH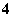 、SO
、SO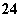 、CO
、CO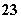 、NO
、NO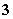
C.该溶液一定不含有NO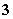 D.该溶液一定含有Na+,且c(Na+)≥0.1 mol·L-1
D.该溶液一定含有Na+,且c(Na+)≥0.1 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com