
 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 物质 | CO | CO2 | H2 | CH3OH(g) |
| 标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
| a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| b | 387 | 0.40 | 0 | 0 | ||
| c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
分析 (1)化学反应热:△H=生成物标准生成热综合-反应物标准生成热总和,结合图表数据和反应ⅠCO(g)+2H2(g)?CH3OH(g)△H1,ⅡCO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2=-58kJ/mol,ⅢCO2(g)+H2(g)?CO(g)+H2O(g)△H3,结合盖斯定律计算分析;
(2)A.对比a、c可知,升高温度CH3OCH3(g)的物质的量减小,说明平衡逆向移动,而升高温度平衡向吸热反应移动;
B.b等效为a中平衡基础上压强增大一倍,反应气体体积不变,平衡不移动;
C.温度越高,反应速率越快;
D.根据a中数据计算平衡常数,计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
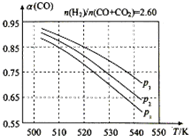
(3)①由图可知,压强一定时,随温度的升高,CO的转化率降低,根据升高温度对反应①、③的影响,进行分析CO转化率变化原因;
②相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子式减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大;
(4)从装置结构分析,硫酸做电解质溶液,负极甲醇失电子得到二氧化碳,结合电荷守恒书写电极反应.
解答 解:(1)A.反应Ⅰ、CO(g)+2H2(g)?CH3OH(g)△H1=-201.25KJ/mol-(-110.52KJ/mol)-0=-90.73 kJ/mol,
故答案为:-90.73 kJ/mol;
B.Ⅱ、CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2=-58kJ/mol,
Ⅲ、CO2(g)+H2(g)?CO(g)+H2O(g)△H3,
盖斯定律计算Ⅱ-Ⅲ得到CO(g)+2H2(g)?CH3OH(g)△H=(-58kJ/mol-△H3)=-90.73 kJ/mol,△H3=+32.73KJ/mol,则△H3>0,
故答案为:>;
(2)A.对比a、c可知,升高温度CH3OCH3(g)的物质的量减小,说明平衡逆向移动,而升高温度平衡向吸热反应移动,则正反应为放热反应,故A正确;
B.b等效为a中平衡基础上压强增大一倍,反应气体体积不变,平衡不移动,容器a中的CH3OH体积分数与容器b中的相等,故B错误;
C.a中温度高,反应速率快,到达平衡时间更短,故C错误;
D.容器a中平衡时c(CH3OCH3)=c(H2O)=$\frac{0.08mol}{1L}$=0.080mol/L,c(CH3OH)$\frac{0.2mol-0.08mol×2}{1L}$=0.04mol/L,容器a中化学平衡常数K1=$\frac{0.08×0.08}{0.0{4}^{2}}$=4,此时浓度商Qc=$\frac{0.15×0.1}{0.1{5}^{2}}$=0.67<K=4,反应向正反应进行,故D正确,
故答案为:AD;
(3)①由图可知,压强一定时,随温度的升高,CO的转化率减小,反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小,
故答案为:减小;反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小;
②相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高,故压强:P1>P2>P3,
故答案为:P1>P2>P3;相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高;
(4)甲醇可以制成燃料电池,与合成气制成燃料电池相比优点是装置简单,减小了电池的体积,负极甲醇失电子得到二氧化碳,结合电荷守恒书写电极反应CH3OH-6e-+H2O=CO2+6H+,
故答案为:装置简单,减小了电池的体积;CH3OH-6e-+H2O=CO2+6H+.
点评 本题考查反应热有关计算、平衡常数及其影响因素、化学平衡的影响因素、化学平衡图象综合应用、原电池原理的理解分析等,侧重考查学生分析计算能力,需要学生具备扎实的基础,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| C. | 侯氏制碱法的最终产品是小苏打 | |
| D. | 明矾可用于水的杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
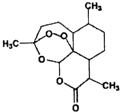 屠呦呦等科学家用乙醚从青蒿中提取出青蒿素,其结构如图所示,已知结构中含有与H2O2相似的过氧键.下列说法正确的是( )
屠呦呦等科学家用乙醚从青蒿中提取出青蒿素,其结构如图所示,已知结构中含有与H2O2相似的过氧键.下列说法正确的是( )| A. | 青蒿素的结构中含有过氧键受热容易分解 | |
| B. | 乙醚的结构简式为:CH3OCH3 | |
| C. | 青蒿素溶于热水,所以应加热加快溶解 | |
| D. | 乙醚易溶于水,不能用分液的方法分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸:CH3COOH、H2SO3、NaHCO3、HF | B. | 碱:Cu2(OH)2CO3、NaOH、Fe(OH)2、Mg(OH)2 | ||
| C. | 盐:AgCl、BaSO4、NaH2PO4、Mg(NO3)2 | D. | 酸性氧化物:CO、CO2、SO2 SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
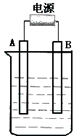 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应均为黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃.
已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应均为黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com