
| A. | 水分子 | B. | 水原子 | C. | 氢、氧两种原子 | D. | 以上都不是 |
科目:高中化学 来源: 题型:选择题
| A. | SO2使紫色石蕊溶液变红色:SO2+H2O=2H++SO32- | |
| B. | 利用NaOH溶液除去金属铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O | |
| C. | 向淀粉碘化钾溶液中加稀硫酸,在空气中放置一段时间后变蓝:4H++4I-+O2=2I2+2H20 | |
| D. | 用盐酸洗涤试管中的Cu(OH)2:Cu(OH)2+2H+=Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) | |
| B. | 1.0 mol•L-1Na2C2O4溶液:c(OH-)=c(HC2O4-)+c(H+)+c(H2C2O4) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:c(OH-)+c(A-)=c(H+)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
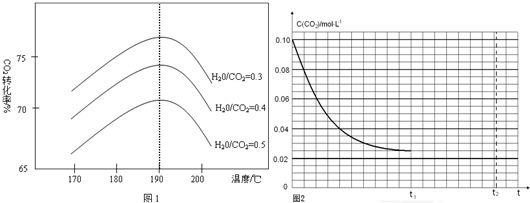

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M(NO3)2 | B. | M(NO3)3 | C. | MNO3 | D. | M2(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X由四种元素组成 | B. | X是化合物 | C. | X中有水 | D. | X 很稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CS2熔点高于CO2,其原因是者都为分子晶体,相对分子质量越大,分子间作用力越大
CS2熔点高于CO2,其原因是者都为分子晶体,相对分子质量越大,分子间作用力越大查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、HD、C3H8 | B. | P2O5、CO2、H3PO4 | C. | SO2、SiO2、CS2 | D. | CCl4、(NH4)2S、H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com