
【题目】水煤气是重要燃料和化工原料,可用水蒸气通过炽热的碳层制得:
C(s)+H2O(g)![]() CO(g)+H2(g)△H=+131.3kJmol-1
CO(g)+H2(g)△H=+131.3kJmol-1
(1)该反应的化学平衡常数表达式K= ,若某温度下,K值的大小为0.5,此时向体积为1L的密闭容器中加入1mol H2O(g)和足量C(s),H2O(g)的平衡转化率为
(2)对于该反应,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 。
a.升高温度 b.增大水蒸气的浓度 c.加入催化剂 d.降低压强
(3)上述反应达到平衡后,移走体系中部分C(s),平衡 ,将产生的CO全部移走,平衡 (以上两空选填“向左移”、“向右移”、“不移动”)。
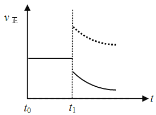
(4)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
增大容器体积(用实线表示) ②升高温度(用虚线表示)
【答案】(1)K=c(CO)·c(H2)/c(H2O)(2分);50%(2分)
(2)a(2分)(3)不移动(2分);向右移(2分)
(4)
【解析】
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据方程式可知该反应的化学平衡常数表达式K=c(CO)·c(H2)/c(H2O);
C (s) + H2O(g)![]() CO (g) +H2 (g) △H=+131.3 kJmol-1
CO (g) +H2 (g) △H=+131.3 kJmol-1
起始量(mol/L) 1 0 0
转化量(mol/L) x x x
平衡量(mol/L) 1-x x x
则根据平衡常数可知![]()
解得x=0.5
所以H2O(g)的平衡转化率为50%
(2)a.正反应吸热,升高温度反应速率加快,平衡向正反应方向进行,氢气的百分含量增加,a正确;b.增大水蒸气的浓度反应速率加快,平衡向正反应方向进行,但氢气的百分含量不一定增加,b错误;c.加入催化剂加快反应速率,但平衡不移动,c错误;d.降低压强反应速率减小,d错误,答案选a。
(3)碳是固体,将C全部移走,平衡不移动;将产生的CO全部移走,生成物浓度降低,平衡向右移动;
(4)①扩大容器体积,压强减小,瞬间正、逆反应速率均减小,平衡向正反应移动,逆反应速率增大到新平衡;②升高温度,瞬间正、逆反应速率增大,平衡正反应移动,逆反应速率增大到新平衡,因此图像表示为(见答案)。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下雪时,常用融雪剂清理路面,醋酸钾( CH3COOK)是效果较好的融雪剂,下列关于1 mol CH3COOK的叙述正确的是( )
A.摩尔是国际单位制中七个基本物理量之一
B.CH3COOK的摩尔质量为98 g
C.1 mol CH3COOK含有2 mol氧
D.1 molCH3COOK含有3×6.02×1023个H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是( )
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 蒸馏中,冷却水应从冷凝管的下口通入,上口流出
D. 过滤操作时,漏斗颈下端不能紧靠烧杯内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是
A.在pH = 13的溶液中,K+、Cl—、HCO3—、Ba2+可以大量共存
B.在pH=0的溶液中,Na+、NO3—、Fe2+、K+可以大量共存
C.由0.1mol/L一元碱BOH溶液的pH=10,可知:BOH=B++OH—
D.由0.1 mol/L一元酸HA溶液的pH=3,可知:A—+ H2O ![]() HA+ OH—
HA+ OH—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”;在常温下,下列可以盛放在铁制容器中的物质是( )
A.浓H2SO4
B.稀HNO3
C.盐酸
D.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其他产物已略去):
![]()
下列说法不正确的是
A.若W是单质铁,则Z溶液可能是FeCl2溶液
B.若W是盐酸,则X与Z可反应生成Y
C.若X是FeCl3溶液,则W可以是Zn或Al
D.若W是硝酸溶液, 则X与Z不能反应生成Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com