

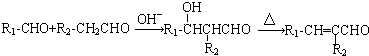
 .反应①~⑤中属于取代反应的有③④⑤(填序号).
.反应①~⑤中属于取代反应的有③④⑤(填序号). .
. .
. 分析 根据题干制备流程可知,呋喃甲醛与乙醛在碱性条件下反应生成A,则A的结构简式为: ;
; 与银氨溶液反应生成呋喃丙烯酸,呋喃丙烯酸与硝酸在浓硫酸作用下反应生成B:
与银氨溶液反应生成呋喃丙烯酸,呋喃丙烯酸与硝酸在浓硫酸作用下反应生成B: ,反应③方程式为:
,反应③方程式为: ;
; 与POCl3反应生成
与POCl3反应生成 ,
, 与H2NCH(CH3)2反应生成呋喃丙胺:
与H2NCH(CH3)2反应生成呋喃丙胺: ,据此进行解答.
,据此进行解答.
解答 解:制备流程为:呋喃甲醛与乙醛在碱性条件下反应生成A,则A的结构简式为: ;
; 与银氨溶液反应生成呋喃丙烯酸:
与银氨溶液反应生成呋喃丙烯酸: ,呋喃丙烯酸与硝酸在浓硫酸作用下反应生成B:
,呋喃丙烯酸与硝酸在浓硫酸作用下反应生成B: ,反应③方程式为:
,反应③方程式为: ;
; 与POCl3反应生成
与POCl3反应生成 ,
, 与H2NCH(CH3)2反应生成呋喃丙胺,
与H2NCH(CH3)2反应生成呋喃丙胺,
(1)根据题干提供的反应原理可知,A的结构简式为: ,
, 转化成
转化成 的反应①为加成反应和消去反应;
的反应①为加成反应和消去反应;
反应② 与银氨溶液的反应为氧化反应;
与银氨溶液的反应为氧化反应;
反应③ 为取代反应;
为取代反应;
反应④ 与POCl3反应生成
与POCl3反应生成 ,该反应为取代反应;
,该反应为取代反应;
反应⑤ 为取代反应,
为取代反应,
所以属于取代反应的为:③④⑤,
故答案为: ;③④⑤;
;③④⑤;
(2)呋喃丙烯酸( )具有多种同分异构体,呋喃丙烯酸中含有1个环、3个碳碳双键、1个碳氧双键,其不饱和度为:1+3+1=5,含有7个C原子,形成的有机物中属于醛类且含有酚羟基的同分异构体中,苯环的不饱和度为4,醛基的不饱和度为1,即:满足条件的有机物分子中含有1个苯环、1个醛基、2个酚羟基,①两个羟基在苯环的邻位碳上时,如图:
)具有多种同分异构体,呋喃丙烯酸中含有1个环、3个碳碳双键、1个碳氧双键,其不饱和度为:1+3+1=5,含有7个C原子,形成的有机物中属于醛类且含有酚羟基的同分异构体中,苯环的不饱和度为4,醛基的不饱和度为1,即:满足条件的有机物分子中含有1个苯环、1个醛基、2个酚羟基,①两个羟基在苯环的邻位碳上时,如图: ,醛基可以在1、2号C,存在两种同分异构体;②两个羟基在间位C原子上时,如图:
,醛基可以在1、2号C,存在两种同分异构体;②两个羟基在间位C原子上时,如图: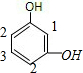 ,醛基可以在1、2、3号C上,存在3种同分异构体;③两个羟基中苯环的对位C上时,如图:
,醛基可以在1、2、3号C上,存在3种同分异构体;③两个羟基中苯环的对位C上时,如图: ,苯环上的4个H原子位置等效,只存在1种同分异构体,所以总共含有6种满足条件的结构,
,苯环上的4个H原子位置等效,只存在1种同分异构体,所以总共含有6种满足条件的结构,
故答案为:6;
(3)反应③为呋喃丙烯酸与硝酸在浓硫酸作用下反应生成 ,反应的化学方程式为:
,反应的化学方程式为: ,
,
故答案为: ;
;
(4) 与H2NCH(CH3)2发生取代反应生成呋喃丙胺,化学方程式为
与H2NCH(CH3)2发生取代反应生成呋喃丙胺,化学方程式为 ,
,
故答案为: .
.
点评 本题考查了有机物的合成,题目难度较大,注意掌握常见有机物结构与性质,明确制备流程及题干反应原理为解答关键,(2)为难点、易错点,注意掌握同分异构体的书写方法,试题侧重考查学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | H2 |
| B | 胆矾 | 石灰水 | 硫酸钡 | H2CO3 | NH3 |
| C | 火碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 冰醋酸 | 福尔马林 | 苛性钾 | 氯化氢 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28.4 | B. | 71g•mol-1 | C. | 28.4g•mol-1 | D. | 71 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 都属于碱性氧化物 | |
| B. | 溶于水后,所得水溶液的成分相同 | |
| C. | 都能和水发生化合反应 | |
| D. | 分别和二氧化碳反应都生成同一种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.请回答下列问题: ;
; ,原子序数比W多1的元素其单质能使W的氢化物水溶液变浑浊,写出反应的化学方程式Cl2+H2S=S↓+2HCl;
,原子序数比W多1的元素其单质能使W的氢化物水溶液变浑浊,写出反应的化学方程式Cl2+H2S=S↓+2HCl;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 需区分的物质 | 区分方法 |
| A | 蒸馏水和自来水 | ①蒸发 ②看颜色 |
| B | 食盐和面碱(Na2CO3) | ①加食醋 ②测其溶液酸碱性 |
| C | 小苏打和碳酸氢氨 | ①灼烧 ②做焰色反应 |
| D | 黑醋和酱油 | ①闻气味 ②尝味道 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | CH3COOH=CH3COO+H+ | ||
| C. | FeCl3=Fe3++3Cl- | D. | NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的电化学装置,可用于净化处理厕所排放废水中的尿素( H2 NCON H2),同时产生电能.下列有关说法不正确的是( )
如图所示的电化学装置,可用于净化处理厕所排放废水中的尿素( H2 NCON H2),同时产生电能.下列有关说法不正确的是( )| A. | 右侧的多孔碳电极是原电池的负极 | |
| B. | 电解质溶液中H十向左侧移动 | |
| C. | 正极上发生还原反应:H2NCONH2+H2O-6e-═c-CO2+N2+6N+ | |
| D. | 电极上消耗标准状况下33.6LO2,电路中转移6 mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com