
【题目】每年6月5日为世界环境日。下列有关环保建议不能采纳的是
A.开发利用太阳能B.提倡垃圾分类处理
C.改进汽车尾气净化技术D.将工业废水直接排放
科目:高中化学 来源: 题型:
【题目】根据阿伏加德罗定律的相关内容,下列说法错误的是( )
A.温度相同、体积相同的 O2(g)和 N2(g)分子数相同
B.等温等压下,SO2气体与 CO2气体的密度之比等于 16:11
C.温度和容积相同的两气罐中分别盛有 5 mol O2(g)和 2 molN2 (g),两容积中的压强之比等于 5:2
D.等温等压条件下,5 molO2(g)和 2 molH2(g)的体积之比等于 5:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题
(1)H2SO4与HNO3的摩尔质量分别为、 , 9.8g H2SO4与g HNO3所含的分子数相同,它们所含氢原子数之比是 .
(2)一定量H2SO4与HNO3中的氧原子数相等,则溶液中H2SO4与HNO3的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol NH4+ 所含质子数为10NA
B.10克氖气所含原子数约为6.02×1023
C.标准状况下,22.4 L SO2所含的分子数为NA
D.常温常压下,32 g O2和O3的混合气体所含原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.在一定体积和一定条件下有反应N2(g)+3H2(g)![]() 2NH3(g),现分别从两条途径建立平衡:
2NH3(g),现分别从两条途径建立平衡:
Ⅰ.起始浓度N2:1 mol·L-1,H2:3 mol·L-1
Ⅱ.起始浓度N2:2 mol·L-1,H2:6 mol·L-1
则下列叙述正确的是( )
A. Ⅰ和Ⅱ两途径达到平衡时,体系内各成分的体积分数相同
B. 达到平衡时,途径Ⅰ的反应速率v(H2)等于途径Ⅱ的反应速率v(H2)
C. 达到平衡时,途径Ⅱ体系内混合气体的压强是途径Ⅰ内混合气体压强的2倍
D. 达到平衡时,途径Ⅰ体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚硝酰(NOCl)具有强氧化性,易与水反应生成HCl和氮氧化物。实验室可通过反应Cl2+2NO![]() 2NOCl △H<0制备
2NOCl △H<0制备
回答下列问题:
(1)甲组同学拟用下图所示装置(夹持仪器未画出)拟制备Cl2和NO。

①制取Cl2时,分液漏斗中加入浓盐酸,则烧瓶中放入的固体药品可能是______。
②制取NO时,铜与稀硝酸反应的离子方程式为_________。
(2)乙组的同学制氯化亚硝酰(沸点为-5.5℃)的装置如下:
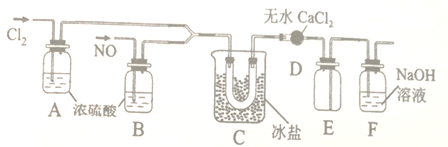
①装置D的作用是___________;装置E的作用是________。
②装置C中冰盐冷却的目的是___________(写两点)。
(3)丙组依据文献记载,氯化亚硝酰也可用NaNO2固体与气体制备,该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。
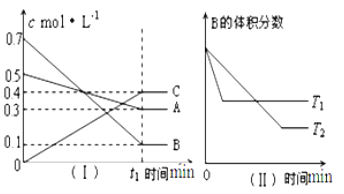
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为_________,达到平衡时A的转化率为_____。T1____T2(大于,小于,等于),正反应为_____(填“吸热”或“放热”)反应。
(2)t1 min后,改变下列某一条件,能使平衡向逆反应方向移动的有___________(填字母编号)。
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间通过一步就能实现如图所示转化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
① |
| Na2O | Na2O2 | Na | NaOH |
② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | NO | NO2 | N2 | HNO3 |
A. ①② B. ②③. C. ②④ D. ①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com