
【题目】某研究性学习小组的同学对![]() 、
、![]() 、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
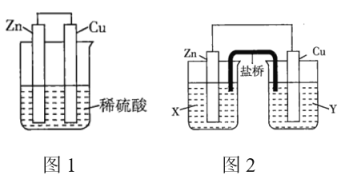
(1)实验表明,图1中铜电极上有气泡产生,说明反应中有一部分化学能转化为_______能。
(2)图2中的X、Y分别是![]() 溶液、稀硫酸,实验过程中只有正极上产生气泡,则X是_______,正极上的电极反应式为_______。
溶液、稀硫酸,实验过程中只有正极上产生气泡,则X是_______,正极上的电极反应式为_______。
(3)当图1装置中的溶液质量增加![]() 时,生成氢气_______L(标准状况);当图2中锌电极的质量减少
时,生成氢气_______L(标准状况);当图2中锌电极的质量减少![]() 时,电路中转移的电子为_______
时,电路中转移的电子为_______![]() 。
。
【答案】电 ![]()
![]() 溶液
溶液 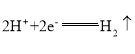 22.4 2
22.4 2
【解析】
(1)该装置为原电池,锌为负极,铜做正极,电子由负极经导线流经正极;
(2)根据反应Zn+H2SO4=ZnSO4+H2原理可知,锌失去的电子经过导线转移到铜片表面,溶液中的H+在铜片上得到电子,放出H2,据此分析;
(3)图1装置中负极1mol锌完全溶解进入溶液中,正极上有1mol氢气析出,因此溶液质量增加63g;图2中当锌电极的质量减少1mol时,根据Zn-2e-=Zn2+可计算出电路中转移电子的量。
(1)锌失去的电子经过导线转移到铜片表面,铜电极上有气泡产生,说明反应中有一部分化学能转化为电能;
(2)锌失去的电子经过导线转移到铜片表面,溶液中的H+在铜片上得到电子,放出H2,则锌浸在![]() 溶液中,铜浸在稀硫酸中;正极极反应为:
溶液中,铜浸在稀硫酸中;正极极反应为: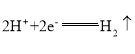 ;
;
(3)当图1装置中的溶液质量增加63g时,溶解的锌为65g,生成的氢气为2g,在标准状况下氢气的体积为![]() ;当图2中锌电极的质量减少
;当图2中锌电极的质量减少![]() 时,即消耗Zn的物质的量为1mol,根据:Zn-2e-=Zn2+可知,电路中转移2mol电子。
时,即消耗Zn的物质的量为1mol,根据:Zn-2e-=Zn2+可知,电路中转移2mol电子。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有常温下![]() 的醋酸和
的醋酸和![]() 的硫酸两种溶液,下列叙述正确的是( )
的硫酸两种溶液,下列叙述正确的是( )
A.两溶液中水电离出的![]() 均为
均为![]()
B.加水稀释100倍后两溶液的pH仍相同
C.醋酸中的![]() 和硫酸中的
和硫酸中的![]() 相同
相同
D.等体积的两溶液中分别加入足量锌片时放出![]() 的体积相同
的体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) 4NO2(g)+ O2(g) △H >0, T1温度下的部分实验数据为
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A.500s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1000s时N2O5转化率为50%
C.T1温度下的平衡常数为K1 ,T2温度下的平衡常数为K2,若K1<K2,则T1 >T2
D.平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时c(N2O5) >5.00mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() →
→![]() 。应用这一反应,下列化合物中可以与钠合成环丁烷的是( )
。应用这一反应,下列化合物中可以与钠合成环丁烷的是( )
A.CH3BrB.CH3CH2CH2CH2Br
C.CH2BrCH2CH2CH2BrD.CH3CHBrCH2CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:
化学式 |
|
| HClO |
电离平衡常数 |
|
|
|
回答下列问题:
(1)一般情况下,当温度升高时,![]() ______填“增大”、“减小”或“不变”。
______填“增大”、“减小”或“不变”。
(2)下列四种离子结合质子能力由大到小的顺序是______填序号;
a、CO32- b、ClO- c、CH3COO- d、HCO3-
(3)下列反应不能发生的是______填序号
a. ![]()
b. ![]()
c. ![]()
d. ![]()
(4)用蒸馏水稀释![]() 的醋酸,下列各式表示的数值随水量的增加而增大的是______填序号;
的醋酸,下列各式表示的数值随水量的增加而增大的是______填序号;
a. 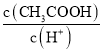 b.
b. ![]() c.
c.![]() d.
d.![]()
(5)体积均为10mLpH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。
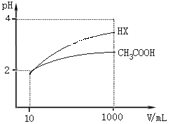
则HX的电离平衡常数______填“大于”、“等于”或“小于”,下同醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)______醋酸溶液中水电离出来的c(H+),理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷等元素及其化合物在现代农业、科技、国防建设中有着许多独特的用途。
⑴基态砷原子中能量最高的能级为________,下列有关表示基态氮原子的排布图中,仅违背洪特规则的是________。
A.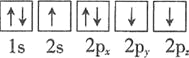
B.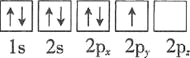
C.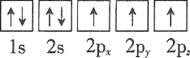
D.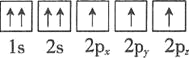
⑵肼是一种良好的火箭发射燃料,传统制备肼的方法是NaClO + 2NH3 = N2H4 + NaCl + H2O,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。
①氮、氧、钠三种元素的第一电离能由大到小的顺序为________。
②N2H4中氮原子的杂化轨道类型为________,H2O的分子构型为________。
③NH3、H2O两分子中心原子杂化类型相同,但水分子中键角比NH3中的键角小,其原因是________________________________________,导致肼与氨气熔点、沸点差异最主要的原因是______________________________________________________________。
⑶有“半导体贵族”之称砷化镓晶体中,As、Ga原子最外电子层均达到8电子稳定结构,则该晶体中的化学键的类型有________。
A. 离子键 B. 极性键 C. 配位键 D. ![]() 键
键
⑷由氮、铂(Pt)两元素形成的某种二元化合物的晶胞如图所示,则该化合物的化学式________,若该晶胞的边长为d pm,则该晶体的密度为________ gcm-3。
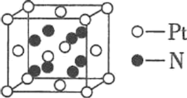
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol·L-1 AlC13溶液中:H+、Na+、Cl-、SO![]()
B.含有0.1mol·L-1 Fe3+的溶液中:Na+、K+、SCN-、NO![]()
C.使甲基橙变红色的溶液中:Fe2+、K+、NO![]() 、SO
、SO![]()
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:NH![]() 、SO
、SO![]() 、HCO
、HCO![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,某溶液中,
时,某溶液中,![]() 、
、![]() 、
、![]() 三者所占的物质的量分数
三者所占的物质的量分数![]() 随溶液pH变化关系如下图所示,下列叙述错误的是
随溶液pH变化关系如下图所示,下列叙述错误的是

A.![]() 是二元弱酸,其
是二元弱酸,其![]()
B.![]() 时,
时,![]() ,溶液中还存在
,溶液中还存在![]() 分子
分子
C.NaHR在溶液中![]() 电离程度大于水解程度
电离程度大于水解程度
D.将相同物质的量![]() 与NaHR固体完全溶于水可配得pH为
与NaHR固体完全溶于水可配得pH为![]() 的混合液
的混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼元素、钙元素、铜元素在化学中站有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔。请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为 ______。
② CaC2中C22-与O22+互为等电子体,1mol O22+中含有的![]() 键数目为 ______。
键数目为 ______。
③乙炔与氢氰酸反应可得丙烯睛(H2C=CH-C≡N),丙烯腈分子中碳原子轨道杂化类型是 ______,构成丙烯腈元素中第一电离能最大的是 ______。
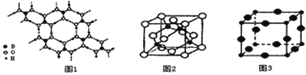
(2)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢健相连(如上图1)则1molH3BO3的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸B(OH)3H2O,它电离生成少量[B(OH)4]-和H+,则[B(OH)4]-的空间构型为 ______。
(3)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如上图2所示(黑点代表铜原子,空心圆代表M原子)。
![]() 该晶体化学式为 ______。
该晶体化学式为 ______。
![]() 已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ (填“离子”、“共价”)化合物。
已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ (填“离子”、“共价”)化合物。
(4)Cu3N的晶胞结构如上图3,N3-的配位数为 ______ ,Cu+半径为apm,N3-半径为bpm,Cu3N的密度为 ______gcm-3(阿伏加德罗常数用NA表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com