
 下表各组物质中,通过一步反应不能实现如图所示转化的是( )
下表各组物质中,通过一步反应不能实现如图所示转化的是( )| 选项 | a | b | c |
| A | Al2O3 | NaAlO2 | Al(OH)3 |
| B | CO2 | Na2CO3 | NaHCO3 |
| C | NO | NO2 | HNO3 |
| D | Fe2O3 | FeCl3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Al2O3能与氢氧化钠反应生成NaAlO2,NaAlO2可与盐酸反应生成Al(OH)3,Al(OH)3能加热分解生成Al2O3;
B.CO2能与氢氧化钠反应生成Na2CO3,向Na2CO3溶液中通入CO2反应可生成NaHCO3,NaHCO3能加热分解生成CO2;
C.NO与氧气反应可生成NO2,NO2与水和氧气反应可生成HNO3,铁可与HNO3反应生成NO;
D.氢氧化钠可与过量的二氧化碳反应生成碳酸氢钠,碳酸氢钠加热反应生成碳酸钠,碳酸钠与氢氧化钡反应生成氢氧化钠.
解答 解:A.Al2O3能与氢氧化钠反应生成NaAlO2,NaAlO2可与盐酸反应生成Al(OH)3,Al(OH)3能加热分解生成Al2O3,故A错误;
B.CO2能与氢氧化钠反应生成Na2CO3,向Na2CO3溶液中通入CO2反应可生成NaHCO3,NaHCO3能加热分解生成CO2,故B错误;
C.NO与氧气反应可生成NO2,NO2与水和氧气反应可生成HNO3,铁可与HNO3反应生成NO,故C错误;
D.氢氧化钠可与过量的二氧化碳反应生成碳酸氢钠,碳酸氢钠加热反应生成碳酸钠,碳酸钠与氢氧化钡反应生成氢氧化钠,故D正确.
故选D.
点评 本题考查无机物的推断,侧重于元素化合物知识的综合运用,难度不大,注意把握相关物质的性质,学习中注意积累.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 17.6 g丙烷中所含的极性共价键为6.4 NA个 | |
| D. | 电解精炼铜时,若阴极得到的电子数为2 NA个,则阳极质量减少64 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
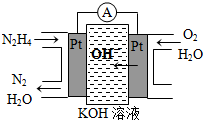 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红热的铁丝在氯气中燃烧产生棕色的烟雾 | |
| B. | 含有氯元素的物质都呈黄绿色 | |
| C. | 氢气在氯气中燃烧时火焰呈淡蓝色,在瓶口有白雾产生 | |
| D. | 钠在空气里加热,先熔成小球,剧烈燃烧,产生黄色火焰,生成淡黄色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将NaOH溶液滴入某溶液中,加热,放出的气体 能使湿润的红色石蕊试纸变蓝 | 证明该溶液中存在NH4+ |
| B | 向某溶液中加入稀盐酸,放出无色气体,将气体通入 澄清石灰水,石灰水变浑浊 | 证明该溶液中存在CO32- |
| C | 将Cl2通入品红溶液中,品红溶液褪色 | 证明Cl2具有漂白性 |
| D | 将酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明H2O2氧化性比Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14.2% | B. | 16% | C. | 17.8% | D. | 19.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
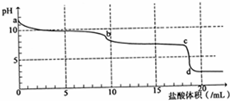 常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )| A. | a点时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) | |
| B. | 当盐酸加入5mL时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) | |
| C. | 当盐酸加入10mL时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | b-c段发生的反应为:HCO3-+H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
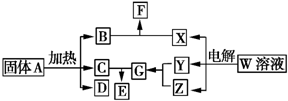 如图所示的无机物的转化关系中,部分生成物和反应条件已略去.其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子.
如图所示的无机物的转化关系中,部分生成物和反应条件已略去.其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子. ;E中含有的化学键类型是离子键和共价键.
;E中含有的化学键类型是离子键和共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com