物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )
A.Ba(OH)2、Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2SO3、KNO3、NH4Cl
C.NH3?H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、C6H5COOH、C2H5OH、HCl
【答案】分析:根据碱溶液的pH>盐溶液的pH>酸溶液的pH,及盐溶液中强酸弱碱盐水解显酸性、强碱弱酸盐水解显酸性、不水解的盐显中性、盐中有弱才水解、越弱越水解等来解答.
解答:解:A、Ba(OH)2为强碱,不水解,溶液呈强碱性,pH远大于7;Na2SO3为强碱弱酸盐,水解呈弱碱性,pH大于7,FeCl3是强酸弱碱盐,水解溶液呈酸性,pH小于7,KCl是强碱强酸盐溶液呈中性,pH等于7,则不是按照pH由大到小排列,故A错误;
B、Na2SiO3、Na2SO3为强碱弱酸盐,水解呈弱碱性,但硅酸的酸性小于亚硫酸,则pH为Na2SiO3>Na2SO3,KNO3强碱强酸盐,溶液呈中性,NH4Cl是强酸弱碱盐,水解溶液呈酸性,pH小于7,则是按照pH由大到小排列,故B正确;
C、NH3?H2O为弱碱,pH值最大,H3PO4显酸性,pH小于7,Na2SO4呈中性,pH等于7,硫酸为强酸,其pH远小于7,则不是按照pH由大到小排列,故C错误;
D、NaHCO3、水解显碱性,其pH大于7,C2H5OH呈中性,C6H5COOH呈酸性,HCl为强酸,其pH远小于7,则不是按照pH由大到小排列,故D错误;
故选B.
点评:本题考查溶液的酸碱性,熟悉盐类水解的规律:谁弱谁水解,谁强显谁性等来判断盐类水解后溶液的酸碱性是解答本题的关键,难度不大.



 综合自测系列答案
综合自测系列答案
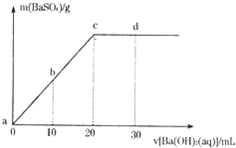 常温下,向0.1mol/L的H2SO4溶液中逐滴加入物质的量浓度相同的Ba(OH)2溶液,生成沉淀的质量和加入Ba(OH)2溶液的体积关系如下图所示,下列有关说法正确的是( )
常温下,向0.1mol/L的H2SO4溶液中逐滴加入物质的量浓度相同的Ba(OH)2溶液,生成沉淀的质量和加入Ba(OH)2溶液的体积关系如下图所示,下列有关说法正确的是( )