
【题目】用惰性电极电解物质的量浓度相同、体积比为1∶3的 CuSO4和 NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O![]() 2Cu+4H++O2↑
2Cu+4H++O2↑
②Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
③2Cl-+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
④2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
A. ①②③B. ①②④C. ②③④D. ②④
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

Ⅰ.(1)从碘水中分离出I2,选择装置_______,该分离方法的名称为_________。
(2)写出上图中仪器①的名称___________________ ;
(3)冷凝管中冷却水的方向为________________________ 。
Ⅱ.实验室要配制2mol/L稀硫酸240mL。
(1)量取18.4mol/L的浓硫酸时,用下面那种规格的量筒___(填序号)
①10mL ②50mL ③100mL ④500mL
(2)配制该稀硫酸时使用的仪器除量筒、烧杯外,还必须用到的仪器有玻璃棒、胶头滴管、________。
(3)在配制过程中,如果出现下列情况,将对所配溶液的物质的量浓度有何影响?(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸时,仰视量筒进行读数________;
②定容时,液面超过刻度线后用胶头滴管吸至液面处______;
Ⅲ.200mL 5mol/L NaOH溶液中,取出20mL溶液,其溶质的质量是___________;将取出的溶液稀释至100mL,其溶质的物质的量浓度是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段,氮元素的常见化合价与部分物质类别的对应关系如图所示。
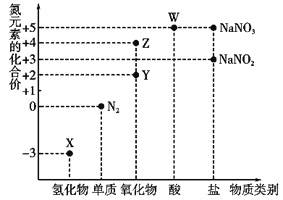
(1)从氮元素化合价的角度分析,X、Y、Z、W中既具有氧化性又具有还原性的有______(填化学式)。
(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_______________。尾气中的NO用酸性NaClO溶液吸收,其原理是HClO氧化NO生成Cl和NO3-,其离子方程式为______________________________________。
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为_______________________。
(4)W的稀溶液与铜单质发生反应的离子方程式为__________________________。
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
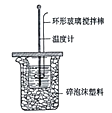
A. 如上图所示是测定中和热的简易装置,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 实验时需要记录初始温度T1和最高温度T2
D. 做一次实验根据公式即可得出中和反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 主要用作选矿剂、伪装涂料的颜料等。用钴矿石
主要用作选矿剂、伪装涂料的颜料等。用钴矿石![]() 含
含![]() 、CoO及少量
、CoO及少量![]() 、
、![]() 、
、![]() 等
等![]() 生产
生产![]() 的流程如图1:
的流程如图1:
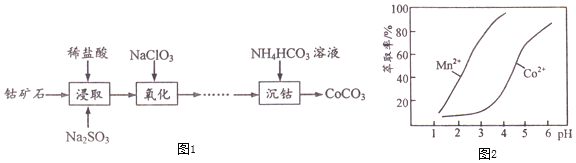
下表列出了几种离子生成氢氧化物沉淀的pH![]() “沉淀完全”是指溶液中离子浓度低于
“沉淀完全”是指溶液中离子浓度低于![]()
|
|
|
|
| |
开始沉淀的pH |
|
|
|
|
|
沉淀完全的pH |
|
|
|
|
|
![]() 写出“浸取”步骤
写出“浸取”步骤![]() 发生反应的离子方程式______。
发生反应的离子方程式______。
![]() “浸取”步骤除
“浸取”步骤除![]() 外,钴矿石中还能被
外,钴矿石中还能被![]() 还原的物质有______。
还原的物质有______。
![]() 加
加![]() 的目的是氧化
的目的是氧化![]() ,
,![]() 的用量过多会造成的不良后果是______。
的用量过多会造成的不良后果是______。
![]() “沉钴”步骤向
“沉钴”步骤向![]() 溶液加入
溶液加入![]() 溶液需要
溶液需要![]() 条件下进行,适宜的加热方式为______。温度控制在
条件下进行,适宜的加热方式为______。温度控制在![]() 的原因为______。
的原因为______。
![]()
![]() 的实验方案:向“氧化”后的溶液中加入______,加入
的实验方案:向“氧化”后的溶液中加入______,加入![]() 溶液沉钴得
溶液沉钴得![]() 实验中须使用试剂:
实验中须使用试剂:![]() 溶液、金属萃取剂、盐酸
溶液、金属萃取剂、盐酸![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如下图所示(a、b为石墨电极).下列说法中,正确的是
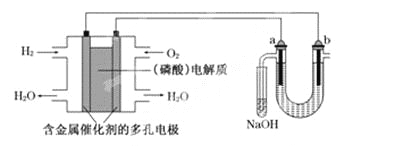
A. 电池工作时,正极反应式为: O2+2H2O+4e-===4OH-
B. 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C. 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D. 忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.04 g H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(1)操作Ⅰ是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_____、_____。(填仪器名称)
(2)下列操作可能使所配溶液浓度偏小的是_____(填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(3)请写出加入氯水发生的离子反应方程式_____。
(4)检验沉淀是否已经洗涤干净的操作是_____。
(5)若原样品质量a为10g,加热后红棕色固体质量是0.6g,则样品中铁元素的质量分数是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废定影液含Ag(S2O3)23-和Br-等,实验室从中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取Cl2并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如图所示,下列叙述正确的是( )
A.用装置甲分离Ag2S时,用玻璃棒不断搅拌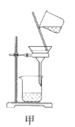
B.用装置乙在通风橱中高温灼烧Ag2S制取Ag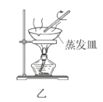
C.用装置丙制备Cl2 
D.用装置丁分液时,先放出水层再换个烧杯继续放出有机层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol/L 的某二元酸 H2A 溶液中,可能存在的所有含 A 粒子的物质的量分数随 pH 变化的关系如图所示。下列说法不正确的是

A.H2A 的电离方程式:H2A=H+ + HA-
B.NaHA 溶液显酸性
C.等物质的量浓度的 NaHA 和Na2A 溶液等体积混合,离子浓度大小关系为:c(Na+)>c(A2-)>c(HA-)
D.pH = 5 时,在NaHA 和 Na2A 的混合溶液中: c(HA-) : c(A2-)= 100:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com