
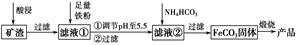
 4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:
4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:
| A.Cu; | B.Cu2(OH)2CO3; | C.H2SO4; | D.Fe;E.CuO |
 2Cu+2H2SO4+O2↑
2Cu+2H2SO4+O2↑ Fe(OH)3+3H+。要求加入的试剂能与H+反应,不能引入除Cu2+、Fe3+外的其他杂质离子,不能与Fe3+反应,故供选试剂中只有B、E适合。(3)电解CuSO4溶液,其产物为Cu、O2和H2SO4。(4)Fe(OH)3与H2SO4反应生成Fe3+,最终要得到绿矾,故试剂a应为铁粉。(5)绿矾含有结晶水,从溶液中分离的操作步骤为蒸发浓缩、冷却结晶,最后过滤即可。(6)电解生成的H2SO4和O2也可循环
Fe(OH)3+3H+。要求加入的试剂能与H+反应,不能引入除Cu2+、Fe3+外的其他杂质离子,不能与Fe3+反应,故供选试剂中只有B、E适合。(3)电解CuSO4溶液,其产物为Cu、O2和H2SO4。(4)Fe(OH)3与H2SO4反应生成Fe3+,最终要得到绿矾,故试剂a应为铁粉。(5)绿矾含有结晶水,从溶液中分离的操作步骤为蒸发浓缩、冷却结晶,最后过滤即可。(6)电解生成的H2SO4和O2也可循环

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
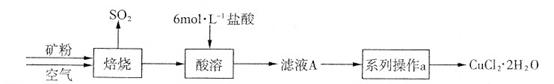
 CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在反应后的溶液中滴加KSCN溶液,溶液呈红色 |
| B.反应后溶液中c(Cl-)=6mol/L |
| C.反应后溶液中加入铁屑不溶解 |
| D.反应后溶液中c(Cu2+): c(Fe2+)=1:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
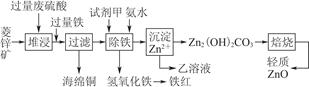
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.3 | 9.7 |
| Fe3+ | 1.5 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol Fe分别与足量的盐酸或氯气反应电子转移数相等 |
| B.水蒸气与铁在常温下反应生成Fe3O4和H2 |
| C.Fe2O3和Al2O3都能溶解于NaOH溶液中 |
| D.生铁中的含碳量高于钢中的含碳量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

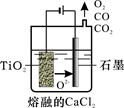
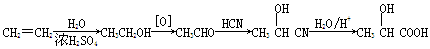
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com