
【题目】在一定条件下,短周期元素R所形成的离子![]() 与R2可发生如下反应:
与R2可发生如下反应: ![]() +2R2+6H+==3R+3H2O,下列关于元素R的叙述中一定正确的是( )
+2R2+6H+==3R+3H2O,下列关于元素R的叙述中一定正确的是( )
A. R原子的最外层上可能有4个电子
B. ![]() 中的R只能被还原
中的R只能被还原
C. R可能是碳元素
D. R最高价氧化物对应水化物为强酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)在一定条件下,CH4可与NOx反应除去NOx,已知下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0kJ·mol-1
2NO2(g) △H=+67.0kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0kJ·mol-1
则CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g) △H=_________kJ·mol-1;
CO2(g)+2H2O(g)+N2(g) △H=_________kJ·mol-1;
(2)哈伯因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖。若用![]() 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:

①吸附后,能量状态最低的是 (填字母序号)。
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图。
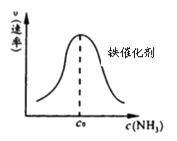
从吸附和解吸过程分析,c0前速率增加的原因可能是 ;c0后速率降低的原因可能是 。
Ⅱ.用石墨作电极电解下列溶液:
①稀H2SO4②K2SO4溶液 ③NaCl溶液 ④CuSO4溶液 ⑤KOH溶液
(1)阴极、阳极都有气体产生,其中溶液pH变大的是______________。(填序号)
(2)已知400mL 0.5 mol·L-1 CuSO4溶液,电解一段时间后,两极产生的气体体积相同,其阳极的电极反应式是_________________,两极共产生气体______________ mol,如要将溶液恢复原浓度,需要加入的物质为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卷柏干枯后,如得到充足的水仍能成活,其原因是
A. 失去的水为自由水 B. 虽失去结合水,但有特殊酶
C. 此生物有特殊的结构 D. 以上都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 核素14C的中子数是6
B. 35Cl和37Cl互为同位素
C. O2和O3互为同素异形体
D. CH3CH2O H和CH3OCH3互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙酸是弱酸的实验事实是
A.CH3COOH溶液与Zn反应放出H2
B.0.1mol/L CH3COONa溶液的pH大于7
C.CH3COOH溶液与NaCO3反应生成CO2
D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ | ⑾ |
(1)写出元素①单质的电子式
(2)这些元素形成的气态氢化物中,最稳定的是
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是
(4)③的最高价氧化物的水化物与⑤的最高价氧化物的水化物反应的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1mol XY2含有54mol电子。
(1)该融雪剂的化学式是____________;X与氢元素形成的化合物的电子式是_______________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是____________;D与E能形成一种结构类似CO2的三原子分子,且每个原子均达到8e稳定结构,该分子的结构式为________________。
(3)Z与Y同主族,Z、Y位于相邻周期,且Z的原子半径大,则Z单质常温下呈_____态(填“气”“液”或“固”)。
(4)元素W与D同主族,且W与D可形成两种常见化合物,其中能使品红溶液褪色的是____________(填化学式),写出其与Z单质的水溶液反应的化学方程式:____________________。
(5)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2(R为1价),该反应的离子方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点
(1)氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,其相关反应的主要热化学方程式如下:
反应①:NH3(aq)+HClO(aq)= NH2Cl(aq)+H2O(l)△H1= akJmol﹣1
反应②:NH2Cl(aq)+HClO(aq)= NHCl2(aq)+H2O(I)△H2= bkJmol﹣1
反应③:2NHCl2(aq)+H2O(l)= N2(g)+HClO(aq)+3HCl(aq)△H3= ckJmol﹣1
① 2NH3(aq)+3HClO(aq)= N2(g)+3H2O(I)+3HCl(aq)的△H=______。
② 溶液pH对次氯酸钠去除氨氮有较大的影响(如图1所示)。在pH较低时溶液中有无色无味的气体生成,氨氮去除效率较低,其原因是_________________。
③ 用电化学法也可以去除废水中氨氮.在蒸馏水中加入硫酸铵用惰性电极直接电解发现氨氮去除效率极低,但在溶液中再加入一定量的氯化钠后,去除效率可以大大提高。反应装置如图2所示,b为电极__极,电解时阴极的电极反应式为_____________。

(2)“低碳经济”正成为科学家研究的主要课题。
① 以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2 和CH4 直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是__________________。
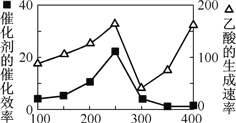
② 为了提高该反应中CO2的转化率,可以采取的措施是_____________。(写一条即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com