
| A. | 在一定体积和浓度的醋酸和氢氧化钠的混合液中一定存在:c(OH-)+c(CH3COO-)=c(H+)+c(Na+) | |
| B. | 常温下pH=10的NaOH和NH3•H2O,加水稀释至pH=9,NaOH加水多 | |
| C. | 难溶电解质CaF2饱和溶液中,c(Ca2+)=amol/L,c(F-)=bmol/L,则Ksp=4ab | |
| D. | 0.1mol/L的碳酸钠溶液中,阴离子浓度大小顺序为:c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$)>c(OH-) |
分析 A.溶液中一定存在电荷守恒,根据混合液中的电荷守恒判断;
B.一水合氨为弱碱,稀释过程中电离程度增大,氢氧根离子的总物质的量增大,所以氨水中加水多;
C.氟化钙饱和溶液中,Ksp=c(Ca2+)•c2(F-);
D.碳酸钠溶液中,氢氧根离子来自水的电离和碳酸根离子的水解,则c(OH-)>c(HCO3-).
解答 解:A.在一定体积和浓度的醋酸和氢氧化钠的混合液中,根据电荷守恒可得:c(OH-)+c(CH3COO-)=c(H+)+c(Na+),故A正确;
B.常温下pH=10的NaOH和NH3•H2O,氢氧化钠为强电解质,一水合氨为弱碱,稀释过程中氢氧化钠溶液中氢氧根离子总物质的量不变,而氨水中氢氧根离子的物质的量增大,所以加水稀释至pH=9,NaOH加水少、氨水中加水多,故B错误;
C.难溶电解质CaF2饱和溶液中,c(Ca2+)=amol/L,c(F-)=bmol/L,则Ksp=c(Ca2+)•c2(F-)=a×b2,故C错误;
D.0.1mol/L的碳酸钠溶液中,碳酸根离子部分水解,溶液显示碱性,由于氢氧根离子来自水的电离和碳酸根离子的水解,则c(OH-)>c(HCO3-),溶液中正确的浓度大小为:c(CO32-)>c(OH-)>c(HCO3-),故D错误;
故选A.
点评 本题考查了离子浓度大小比较、难溶物溶度积的应用等知识,题目难度中等,注意掌握酸碱混合的定性判断方法、盐的水解原理及其应用、难溶物溶解平衡及溶度积的计算方法,能够根据电荷守恒、物料守恒、质子守恒等知识判断溶液中各离子浓度大小.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁所含电子数目为0.2NA | B. | 16g CH4所含原子数目为NA | ||
| C. | 17gNH3所含中子数目为10 NA | D. | 20g重水(D2O)所含质子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的浓度不再发生变化 | |
| B. | X、Y、Z三种物质体积分数均相等 | |
| C. | 气体总质量保持不变 | |
| D. | 单位时间消耗3molY,同时生成2molZ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
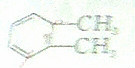 )加氢产物1,2-二甲基环乙烷(
)加氢产物1,2-二甲基环乙烷( )的一氯代产物有(不考虑立体异构)( )
)的一氯代产物有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
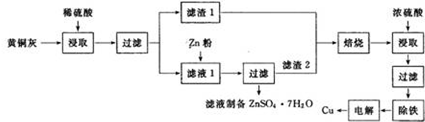 铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.
铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要清洗附着在试管壁上的硫,可用的试剂是CS2 | |
| B. | 硫化亚铁溶于稀硝酸中反应的化学方程式为:FeS+2HNO3→Fe(NO3)2+H2S↑ | |
| C. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 | |
| D. | 在Na2SO3和BaCO3混合物中加入过量的稀硫酸,能产生气泡并有沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com