
分析 NaCl溶液的浓度为0.10 mol•dm-3,即0.10mol/L,加入AgCl,可根据Ksp(AgCl)=c(Ag+)•c(Cl-)=1.8×10-10计算c(Ag+),进而结合n=cV计算.
解答 解:NaCl溶液的浓度为0.10 mol•dm-3,即0.10mol/L,加入AgCl充分溶解,饱和溶液中c(Ag+)=$\frac{1.8×1{0}^{-10}}{0.1}$mol/L=1.8×10-9mol/L,
则n(AgCl)=n(Ag+)=1.8×10-9mol/L×3.0L=5.4×10-9mol,
故答案为:5.4×10-9mol.
点评 本题考查了难溶物质的沉淀溶解平衡的应用,溶度积的计算应用,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等.


科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多
B.由H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ·mol-1可知,若将含1molCH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量小于57.3kJ
C.由C(石墨)=C(金刚石)ΔH=1.9kJ·mol-1可知,金刚石比石墨稳定
D.已知2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,则可知C的燃烧热ΔH=-110.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:选择题
15 g A物质和10.5 g B物质完全反应,生成7.2 g C物质,1.8 g D物质和0.3 mol E物质,则E的摩尔质量为( )
A.16.5 g·mol-1 B.85 g·mol-1 C.27.5 g·mol-1 D.55 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
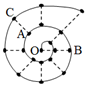 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 原子半径大小顺序:r(B)>r(C)>r(A) | |
| B. | B、C最高价氧化物的水化物可以相互反应 | |
| C. | 虚线相连的元素处于同一族,A、C元素都位于元素周期表ⅥA族 | |
| D. | A分别与B、C形成的化合物中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a<c+d | B. | A的转化率增大 | ||
| C. | D的体积分数变大 | D. | 平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)=10时,c(OH-)+c(H2C2O4)═c(C2O42-)+c(H+) | |
| B. | V(NaOH)=100 mL时,可能存在c(Na+)>2c(C2O42-)+c(HC2O4-) | |
| C. | V(NaOH)=1000 mL时,c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | V(NaOH)=10 mL时,溶液中c(H+)=1×10-12 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
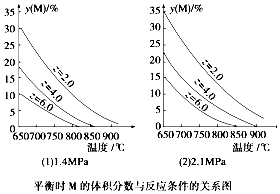
| A. | a+b<c+d | |
| B. | 同温同压时,增加z,平衡时Q的体积分数增加 | |
| C. | 同压同z时,升高温度,气体平均摩尔质量增加 | |
| D. | 同温同z时,增加压强,平衡时Q的物质的量浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
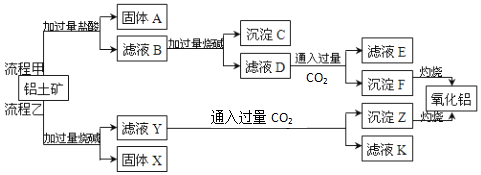
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com