
【题目】下列关于铁及其化合物的叙述正确的是
A.铁粉在Cl2中燃烧生成FeCl2B.铁单质只有还原性,其阳离子只有氧化性
C.Fe(OH)3可经化合反应一步得到D.因为Fe的活泼性大于Cu,故Cu与FeCl3不反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碘化钾可用于有机合成、制药等领域,它是一种白色立方结晶或粉末,易溶于水。有两个学习小组查阅资料后,分别设计以下实验装置制备KI:
【查阅资料】:
(1)3I2+6KOH═KIO3+5KI+3H2O
(2)H2S是有剧毒的酸性气体,具有较强还原性,水溶液称氢硫酸(弱酸);
(3)HCOOH(甲酸)具有强烈刺激性气味的液体,具有较强还原性,弱酸;
(4)在实验条件下,S2-、HCOOH分别被KIO3氧化为SO42-、CO2。
Ⅰ组. H2S还原法,实验装置如图:
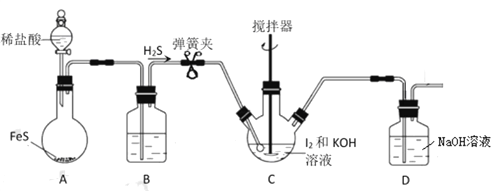
实验步骤如下:
①在上图所示的C中加入127g研细的单质I2和210g 30%的KOH 溶液,搅拌至碘完全溶解。
②打开弹簧夹向其中通入足量的 H2S。
③将装置C中所得溶液用稀H2SO4酸化后,置于水浴上加热10min。
④在装置C的溶液中加入BaCO3,充分搅拌后,过滤、洗涤。
⑤将滤液用氢碘酸酸化,将所得溶液蒸发浓缩,冷却结晶、过滤、洗涤、干燥。得产品145g。
Ⅱ组.甲酸还原法,实验装置如图:
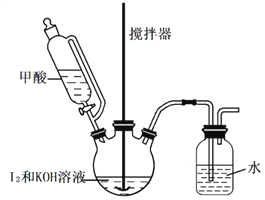
实验步骤如下:
⑥在三颈瓶中加入 127g 研细的单质I2和210g 30%的 KOH 溶液,搅拌至碘完全溶解。
⑦通过滴液漏斗向反应后的溶液中滴加入适量HCOOH,充分反应后,再用KOH溶液调pH至9~10,将所得溶液蒸发浓缩,冷却结晶、过滤、洗涤、干燥。得产品 155g。
回答下列问题;
(1)图中装置 A 中发生反应的离子方程式为__________;装置 B 中的试剂是_________。
(2)D装置的作用是___________。
(3)步骤④的目的是_____________________ 。
(4)步骤⑤中“滤液用氢碘酸酸化”的目的是__________________ 。
(5)Ⅱ组实验的产率为__________________。
(6)Ⅱ组实验中,加入HCOOH发生氧化还原反应的离子方程式为_______________。
(7)与Ⅰ组相比较,Ⅱ组实验的优点是(至少答出两点即可)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1) 以CO2与NH3为原料合成化肥尿素的主要反应如下:
① 2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol1
② NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);ΔH=a kJ·mol1
③ 2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol1
则a为____。
(2) 尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
① 当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=____(空气中氧气的体积含量大约为20%)。
② 如图表示尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为____%。

(3)用稀硝酸吸收NOx,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____。
(4)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图所示。

① 由图知,当废气中的NO含量增加时,宜选用____法提高脱氮的效率。
② 图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,其可能原因为____。
(5)研究表明:NaClO/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。温度高于60℃后,NO去除率下降的原因为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,向0.1mol·L-1的醋酸溶液中加水稀释,溶液中c(H+)/c(CH3COOH)增大
B. 反应N2(g)+3H2(g) ![]() 2NH3(g) (△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
2NH3(g) (△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
C. 镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
D. 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
①CH3OH(g)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
②CO(g)+1/2O2(g)![]() CO2(g) ΔH=-283.0 kJ·mol-1
CO2(g) ΔH=-283.0 kJ·mol-1
③H2(g)+1/2O2(g)![]() H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2 (g)![]() CH3OH(g) ΔH=________ kJ·mol-1。
CH3OH(g) ΔH=________ kJ·mol-1。
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号)。
a. 使用高效催化剂 b. 降低反应温度
c. 增大体系压强 d. 不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
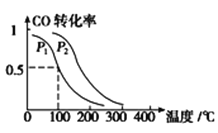
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=_______;
③100℃时,达到平衡后,保持压强P1不变的情况下,再向容器中通入CO、H2和CH3OH各0.5a mol,则平衡_______ (填“向右”、“向左”或“不”移动)。
④在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
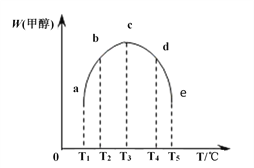
(4)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示。在T1- T2及T4- T5两个温度区间,容器内甲醇的体积分数的变化趋势如图所示,其原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列事实所用的方程式不合理的是
A. 硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 +4H+=2I2+2H2O
B. 将充有NO2的玻璃球浸到热水中,气体颜色加深:2NO2(g)![]() N2O4(g) △H>0
N2O4(g) △H>0
C. 用Na2CO3溶液处理锅炉水垢中的硫酸钙:CO32- +CaSO4 =CaCO3 +SO42-
D. 以KOH溶液为电解质溶液,氢氧燃料电池的负极区pH减小:H2+2OH--2e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+===Cu+Cu2++H2O。
实验探究一 学生甲利用如图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:

(1)仪器组装完成后,夹好止水夹,_________________,则说明装置A的气密性良好。
(2)从下列实验步骤中,选择正确的操作顺序:__________________(填序号)。
①打开止水夹 ②熄灭C处的酒精喷灯 ③C处冷却至室温后,关闭止水夹 ④点燃C处的酒精喷灯 ⑤收集氢气并验纯
实验探究二
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的是________(填选项字母)。
A.若固体全部溶解,说明样品中一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品中一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体证明样品中一定含有________,写出产生上述气体的化学方程式:______________________。
实验探究三
(4)学生丙取一定量样品于烧杯中,加入足量的稀硫酸,反应后经过滤得到固体3.2 g,测得滤液中Fe2+有1.0 mol,则样品中n(Cu2O)=___ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com