
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | - |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________(填序号)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为________________________________________________________________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为________________________________________________________________________;
上述现象说明溶液中________结合OH-的能力比________强(填离子符号)。
(3)B与A的差值为________mol。
(4)B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为________mL。
解析 Ⅰ.由表中数据比较可知,铝的熔点比铁低,该反应放出的热量使铁熔化,此时液态的铁和铝熔合形成铁铝合金。利用金属Al与强碱液反应放出氢气的性质即可验证。由于Fe与Al都是活泼的金属,所以可以用稀硫酸或者稀盐酸溶解。Ⅱ.由图像可知硝酸过量,OC段发生酸碱中和反应,CD段为Fe(OH)3、Al(OH)3沉淀的生成,DE段消耗了NaOH,由此证明硝酸和金属反应的还原产物为较低价态的NH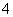 ,EF段为Al(OH)3的消失,只剩下Fe(OH)3沉淀。B与A的差值为Al(OH)3,为4 mol·L-1×(36-34)×10-3 L=0.008 mol,参加反应的n(Al)=0.008 mol,因为1 mol的Al3+、Fe3+均与3 mol的NaOH反应,由电子守恒可知Fe和Al化合价升高的总数等于HNO3生成NH
,EF段为Al(OH)3的消失,只剩下Fe(OH)3沉淀。B与A的差值为Al(OH)3,为4 mol·L-1×(36-34)×10-3 L=0.008 mol,参加反应的n(Al)=0.008 mol,因为1 mol的Al3+、Fe3+均与3 mol的NaOH反应,由电子守恒可知Fe和Al化合价升高的总数等于HNO3生成NH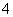 降低的总数,即3n(Fe)+3n(Al)=n(NH
降低的总数,即3n(Fe)+3n(Al)=n(NH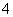 )×8=4 mol·L-1×(34-31)×10-3 L×8,解得n(Fe)+n(Al)=0.032 mol,n(Fe)=0.024 mol,两种沉淀的物质的量为0.032 mol。生成两种沉淀共消耗n(NaOH)=0.032 mol×3=0.096 mol,所以C点体积为:
)×8=4 mol·L-1×(34-31)×10-3 L×8,解得n(Fe)+n(Al)=0.032 mol,n(Fe)=0.024 mol,两种沉淀的物质的量为0.032 mol。生成两种沉淀共消耗n(NaOH)=0.032 mol×3=0.096 mol,所以C点体积为:
31 mL-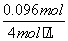 ×103 mL·L-1=7 mL。
×103 mL·L-1=7 mL。
答案 Ⅰ.(1)合理 (2)NaOH溶液 2Al+2OH-+2H2O===2AlO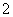 +3H2↑ (3)B
+3H2↑ (3)B
Ⅱ.(1)H++OH-===H2O (2)NH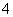 +OH-===NH3·H2O Al3+、Fe3+、H+ NH
+OH-===NH3·H2O Al3+、Fe3+、H+ NH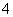 (3)0.008 (4)0.032 7
(3)0.008 (4)0.032 7


科目:高中化学 来源: 题型:
下列变化过程中,原物质分子共价键被破坏,同时还有离子键形成的是( )
A.盐酸和NaOH溶液 B.氯化氢溶于水
C.溴化氢与氨反应 D.锌和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中发生反应的离子方程式如下:
2Cu2++4I-===2CuI(白色)↓+I2
2S2O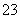 +I2===2I-+S4O
+I2===2I-+S4O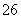
①滴定选用的指示剂为____________,滴定终点观察到的现象为__________________。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,将体积为Va、pH=a的某一元酸与体积为Vb、pH=b的某一元碱混合,请完成下列各题。
(1)若a+b=14,2Va=Vb,碱是NaOH,反应后所得溶液pH小于7。由此你能得到的结论是________________。
(2)若a+b=13,酸是盐酸,碱是KOH,现用盐酸滴定50.00 mL KOH溶液,当滴定到溶液的pH=2时,消耗盐酸11.11 mL。则b=________。
(3)若已知Va<Vb,a=0.5b,酸是强酸,碱是强碱,酸和碱恰好中和,则a的取值范围是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在氢氧化钠溶液和硫酸铜溶液中片刻,如图,则下列说法正确的是( )
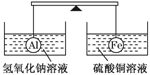
A.两烧杯中均无气泡产生
B.左边烧杯中的溶液质量减少了
C.去掉两烧杯,杠杆仍平衡
D.右边铁球上出现红色
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 | 35 mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
| ① | 水 | 2.5 g NaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2 g Na2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5 g NaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2 g Na2CO3 | 20.0 | 25.1 |
由此得出的结论正确的是 ( )。
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0 ℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1 ℃
D.20.0 ℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低
于16.2 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能获得成功的是 ( )。
A.将乙醛滴入银氨溶液中,加热煮沸制银镜
B.苯与浓溴水反应制取溴苯
C.向苯酚中加浓溴水观察沉淀
D.1 mol·L-1 CuSO4溶液2 mL和0.5 mol·L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钠与水的反应是中学化学中的一个重要反应。该反应的演示方法分别如图甲、乙所示:

(1)现按图甲所示的方法,在室温时,向盛有饱和NaOH溶液的水槽中,加入一小块金属钠。下列有关描述正确的是________(填字母,下同)
a.钠浮在液面上,并四处游动,最后消失
b.钠熔化成一个光亮的小球
c.恢复到室温时,NaOH溶液的浓度增大
d.恢复到室温时,溶液中Na+数目减少
(2)按图乙所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠按下列两种情况收集产生的气体在相同条件下体积的关系是________。
①用铝箔包住钠 ②用铜箔包住钠
a.二者收集气体一样多
b.①收集气体体积较大
c.②收集气体体积较大
查看答案和解析>>
科目:高中化学 来源: 题型:
200 ℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6 g,则原混合物的平均相对分子质量为( )
A.5.8 B.11.6 C.23.2 D.46.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com