
| A. | 纯净的苯酚是粉红色的晶体,65℃以上时能与水互溶 | |
| B. | 苯酚是生产电木的单体之一,与甲醛发生缩聚反应 | |
| C. | 苯酚比苯更易发生苯环上的取代反应 | |
| D. | 苯酚有毒,也能配制洗涤剂和软药膏 |
分析 A.纯净的苯酚本身无色,但其易被氧化,成红色;
B.苯酚和甲醛发生缩聚反应,生成酚醛树脂;
C.苯酚中苯环与羟基相连,由于羟基的影响苯酚中苯环羟基邻、对位H原子活泼;
D.苯酚是有毒的物质,可用来配制洗涤剂和软药膏杀菌消毒.
解答 解:A.纯净的苯酚是无色晶体,易被空气中的氧气氧化为粉红色晶体,故A错误;
B.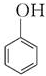 与HCHO发生酚醛缩合反应,反应为n
与HCHO发生酚醛缩合反应,反应为n +nHCHO$\stackrel{H+}{→}$
+nHCHO$\stackrel{H+}{→}$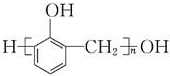 +(2n-1)H2O,苯酚是生产电木的单体之一,故B正确;
+(2n-1)H2O,苯酚是生产电木的单体之一,故B正确;
C.苯酚中苯环与羟基相连,由于羟基的影响苯酚中苯环羟基邻、对位H原子活泼,比苯更容易发生苯环上的取代反应,故C正确;
D.由于苯酚有毒,可用来配制洗涤剂和软药膏杀菌消毒,故D正确;
故选A.
点评 本题考查了苯酚的性质,熟悉苯酚的物理性质和化学性质是解题关键,注意苯酚有毒,也能配制洗涤剂和软药膏,为易错点,题目难度不大.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:实验题
| 实验序号 | a | b | c |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色 | |
| B. | 红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾 | |
| C. | 卤素单质(X2)与水反应均可用X2+H2O=HX+HXO表示 | |
| D. | 溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳振荡,静置后上层颜色变浅,下层颜色变为橙红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去混在Cu粉中的少量Mg粉和Al粉,加稀盐酸后过滤 | |
| B. | 分离汽油和煤油,可用萃取的方法 | |
| C. | 分离硝酸钾和氯化钠固体的混合物,可用溶解、过滤的方法 | |
| D. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
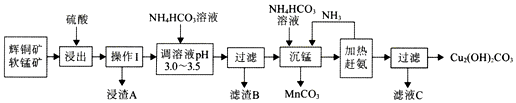
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
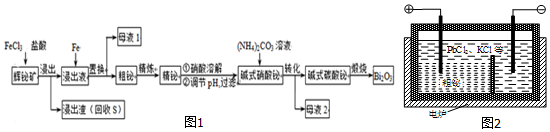
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑火药由硝石、硫磺、木炭按一定比例混合制成,其中“硝石”指的是硝酸钾 | |
| B. | “青篙一握,以水二升渍,绞取汁”,该挺取青蒿素的过程属于化学变化 | |
| C. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合反应 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与A1的物质的量之比为1:1 | |
| B. | 混合气体中 NO为0.03mol,N2O0.12mol | |
| C. | 原HNO3溶液的浓度C=4.6mol/L | |
| D. | 反应中被还原的HNO3为0.18 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com