
【题目】常温下,关于1L pH=3的H2SO4溶液说法正确的是
A.与等体积pH=11氨水混合后所得溶液pH小于7
B.与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7
C.与pH=3的CH3COOH溶液混合后所得溶液pH小于3
D.与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10
【答案】D
【解析】
根据题中可知,本题考查混合溶液pH的计算,运用酸碱中和反应实质及溶液酸碱性与溶液pH的关系进行分析。
硫酸为强电解质,pH=3的硫酸溶液中氢离子浓度为0.001mol/L,
A. 一水合氨为弱电解质,溶液中部分电离出氢氧根离子,pH=11氨水中氢氧根离子浓度为0.001mol/L,两溶液等体积混合后氨水过量,溶液显示碱性,溶液的pH大于7,故A错误;
B. 如果醋酸钠远远过量,反应后生成醋酸和醋酸钠和硫酸钠的溶液,由于醋酸根离子水解程度大于醋酸的电离程度,则溶液显示碱性,溶液的pH大于7,故B错误;
C. 醋酸与硫酸的pH相等,则两溶液混合后溶液中氢离子浓度不变,醋酸根离子与醋酸的浓度变化程度相等,混合后醋酸的电离平衡不移动,溶液的pH=3,故C错误;
D.10LBa(OH)2溶液恰好完全反应,氢氧化钡中氢氧根离子的物质的量等于硫酸中氢离子的物质的量,其物质的量为:0.001mol,则Ba(OH)2溶液中氢氧根离子浓度为:![]() ,溶液的pH等于10,故D正确;
,溶液的pH等于10,故D正确;
答案选D。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组同学用如图装置进行实验,试回答下列问题:
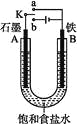
(1)若开始时开关K与a连接,则B极的电极反应为____________________________________。
(2)若开始时开关K与b连接,则B极的电极反应为______,总反应的离子方程式为________。有关上述实验,下列说法正确的是(填序号)___。
①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
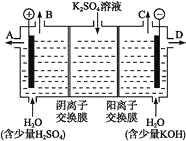
①该电解槽的阳极反应为______。
此时通过阴离子交换膜的离子数______(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因_______________。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯为原料合成F,转化关系如下:
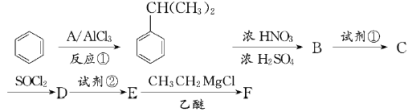
F是一种具有重要工业价值的芳香化合物,含有C、H、O、N四种元素,其蒸气密度是相同状况下氢气密度的74.5倍,分子中有两个互为对位的取代基。C能与碳酸氢钠溶液反应,试剂②为Fe/HCl。
已知:① ;
;
②![]() (苯胺:弱碱性,易被氧化)
(苯胺:弱碱性,易被氧化)
③RCOCl![]() RCOR’
RCOR’
请回答下列问题:
(1)反应①为加成反应,写出A的化学式:_____________。
(2)B中所含官能团的名称为________;生成B时,常伴有副反应发生,反应所得产物除B外可能还含有____________________(写出一种产物的结构简式)。
(3)试剂①是_____________;试剂①和试剂②的顺序能否互换:________(填“能”或“不能”);为什么?_________________________________________________________。
(4)E生成F的化学方程式为__________________________________________________。
(5)参照上述合成路线,以(CH3)2CHCHO和CH3MgCl为原料(无机试剂任选),设计制备(CH3)2CHCOCH3的合成路线____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色澄清溶液中Cl-浓度为0.5 mol·L-1,还可能含有下表中的若干种离子。
阳离子 | K+、Al3+、Mg2+、Ba2+、Fe3+ |
阴离子 | NO3-、CO32-、SiO32-、SO42-、OH- |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下1.12 L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为4.8 g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题:
(1)通过以上实验不能确定是否存在的离子有______________。能确定一定不存在的离子是_____________________________________________________。
(2)实验Ⅰ中生成沉淀的离子方程式为_____________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子______________ (不一定要填满)。
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用菱锰矿(主要成分是MnCO3,含少量A12O3、Fe2O3、FeO、CaO、MgO等)为原料制备MnO2的工艺流程如下:
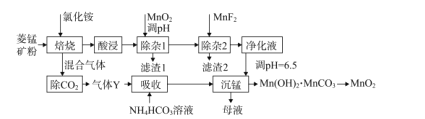
已知:①25℃时,![]()
②相关金属离子![]() 形成氢氧化物沉淀pH范围如下:
形成氢氧化物沉淀pH范围如下:
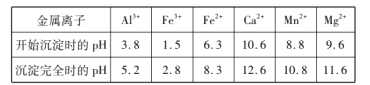
(1)“除杂1”中加入适量MnO2的作用是____,应调节溶液pH不小于____。
(2)“除杂2”的主要目的将Ca2+、Mg2+转化为相应的氟化物沉淀而除去,除去Ca2+的离子方程式为____,该反应的平衡常数为____。
(3)“沉锰”中生成Mn(OH)2'MnCO3沉淀的离子方程式为____,“母液”经加热等系列操作后可返回“____”工序循环使用。
(4)以MnSO4-(NH4)2SO4为电解质溶液,利用下图装置可同时制备金属锰和MnO2。离子交换膜a为____,阳极电极反应式为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径。回答下列问题:
(1)德国化学家F.Haber从1902年开始研究N2和H2直接合成NH3。在1.01×105Pa、250℃时,将1 molN2和1 molH2加入aL刚性容器中充分反应,测得NH3体积分数为0.04;其他条件不变,温度升高至450℃,测得NH3体积分数为0.025,则可判断合成氨反应为 ____填“吸热”或“放热”)反应。
(2)在1.01×105Pa、250℃时,将2 moIN2和2 molH2加入aL密闭容器中充分反应,H2平衡转化率可能为 ___(填标号)。
A =4% B <4% C 4%~7% D >11.5%
(3)我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18049纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氨产量和法拉第效率。反应历程如图所示,其中吸附在催化剂表面的物种用*标注。

需要吸收能量最大的能垒(活化能)E=____ev,该步骤的化学方程式为____,若通入H2体积分数过大,可能造成 ___。
(4)T℃时,在恒温恒容的密闭条件下发生反应:![]() 反应过程中各物质浓度的变化曲线如图所示:
反应过程中各物质浓度的变化曲线如图所示:

①表示N2浓度变化的曲线是 ____(填“A”、“B”或“C’,)。与(1)中的实验条件(1.01×105Pa、450℃)相比,改变的条件可能是_____。
②在0~25min内H2的平均反应速率为____。在该条件下反应的平衡常数为 ___mol-2.L2(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合溶液里lgX[X表示![]() 或
或![]() ]随pH的变化关系如图所示。下列说法不正确的是
]随pH的变化关系如图所示。下列说法不正确的是
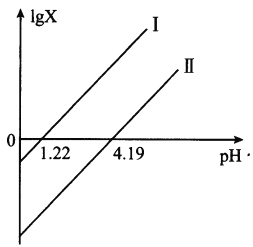
A. 直线I中X表示的是![]()
B. 直线I、Ⅱ的斜率均为1
C. c(HC2O4-)>c(C2O42-)>c(H2C2O4)对应1.22<pH<4.19
D. c(Na+)=c(HC2O4-)+2c(C2O42-)对应pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化铜(II)甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
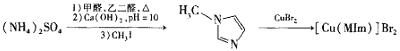
(1)铜元素位于周期表中第_____族,写出基态Cu2+的电子排布式_______。
(2)与![]() 互为等电子体的阴离子为_______。
互为等电子体的阴离子为_______。
(3)![]() 中心原子的杂化方式为_________。
中心原子的杂化方式为_________。
(4)MIm中含σ键与π数目之比为__________。
(5)一种铜的溴化物晶胞结构如图所示。

由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为______。
(6)Cu晶体的堆积方式为面心立方最密堆积,设Cu原子半径为a,晶体中Cu原子的配位数为________,晶体的空间利用率为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com