

���� ��ˮ�й�����ɵĻ������Һ�м�������ʱ��0-Aʱû�г������ɣ�˵����Һ��NaOH����������������ȫת��Ϊƫ��������ӣ���Һ�д��ڵij���ΪMg��OH��2��
A-B�Σ������ƫ�����Ʒ�Ӧ���������������������ӷ�Ӧ����ʽΪH2O+AlO2-+H+=Al��OH��3����B����Һ�д��ڵ��������Ȼ��ƣ�����ΪMg��OH��2��Al��OH��3��
B-C�����У�������þ�����������������ᷴӦ�����Ȼ������Ȼ�þ������C����Һ�е��������Ȼ������Ȼ�þ���Ȼ��ƣ�
��� �⣺��1����ˮ�й�����ɵĻ������Һ�м�������ʱ��0-Aʱû�г������ɣ�˵����Һ��NaOH��������Һ����������ȫת��Ϊƫ��������ӣ���Һ�д��ڵij���ΪMg��OH��2���ʴ𰸣�Mg��OH��2��
��2��A-B�Σ������ƫ�����Ʒ�Ӧ���������������������ӷ�Ӧ����ʽΪH2O+AlO2-+H+=Al��OH��3�����ʴ𰸣�H2O+AlO2-+H+=Al��OH��3����
��3��A���������������þ����n��Mg��OH��2��=$\frac{1.16g}{58g/mol}$=0.02mol������Mgԭ���غ��n��MgCl2��=n��Mg��OH��2��=0.02mol���Ȼ�þ������=0.02mol��95g/mol=1.9g��A-B�Σ������ƫ�����Ʒ�Ӧ���������������������ӷ�Ӧ����ʽΪH2O+AlO2-+H+=Al��OH��3��������HCl�����֪��n��AlO2-��=n��HCl��=1mol/L����0.03-0.01��L=0.02mol���Ȼ���������=0.02mol��133.5g/mol=2.67g��������ԭ���غ��n��AlCl��=n��AlO2-��=0.02mol����Na+���Ӻ�Cl-�����غ�ã�ԭ�������n��NaOH��=n��NaCl��=n��Cl-��=2n��MgCl2��+3n��AlCl3��+n��HCl��=0.02mol��2+0.02mol��3+0.03L��1mol/L=0.13mol�������Ƶ�����=0.13mol��40g/mol=5.2g��
C����ҺΪMgCl2��AlCl3��NaCl���Һ��C���������������к�ԭ������е�NaOH����ʱ�����������ʵ�����
n��HCl��=n��NaOH��=0.13mol��P������ʾ��������Ϊ��V=$\frac{0.13mol}{1mol/L}$=0.13L=130ml�ʴ�Ϊ��1.9��2.67��130��5.2��
���� ����ͼ�������Ľ�����ɣ�Ҫ��ȷÿһ��ͼ�����Ļ�ѧ��Ӧ��֪���յ�����ĺ��弰��Һ�����ʵijɷ֣���Ϸ���ʽ���й�������з�����


 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢۢ� | B�� | �ڢۢ� | C�� | �٢ڢ� | D�� | �٢ڢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����ͼԭ��أ�2KMnO4+10FeSO4+8H2SO4�T2MnSO4+5Fe2��SO4��3+K2SO4+8H2O����������װ�б�����Һ������˵����ȷ���ǣ�������
�����ͼԭ��أ�2KMnO4+10FeSO4+8H2SO4�T2MnSO4+5Fe2��SO4��3+K2SO4+8H2O����������װ�б�����Һ������˵����ȷ���ǣ�������| A�� | ���·���ӵ������Ǵ�a��b | |
| B�� | ��ع���ʱ�������е�SO42-������ձ� | |
| C�� | a�缫�Ϸ����ķ�ӦΪ��MnO4-+8H++5e-�TMn2++4H2O | |
| D�� | ˫Һԭ��ع���ʱ�������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
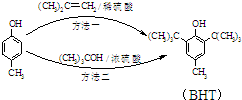 BHT��һ�ֳ��õ�ʳƷ������������
BHT��һ�ֳ��õ�ʳƷ������������ �����ϳ�BHT�ķ�������ͼ���֣�����˵���������
�����ϳ�BHT�ķ�������ͼ���֣�����˵���������| A�� | BHT�� ����ʹ����KMnO4��ɫ ����ʹ����KMnO4��ɫ | |
| B�� | BHT��ˮ�е��ܽ��С�ڱ��� | |
| C�� | ���ַ����ķ�Ӧ���Ͷ��Ǽӳɷ�Ӧ | |
| D�� | ����ɫ��ѧ�Ƕȷ�������һ���ڷ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
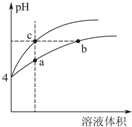 Ϊ��֤��һˮ�ϰ���NH3•H2O����������ʣ��ס��Ҷ��˷ֱ�ѡ�������Լ�����ʵ�飺��ˮ��0.10mol•L-1NH4Cl��Һ��NH4Cl���塢��̪��Һ��pH��ֽ������ˮ��
Ϊ��֤��һˮ�ϰ���NH3•H2O����������ʣ��ס��Ҷ��˷ֱ�ѡ�������Լ�����ʵ�飺��ˮ��0.10mol•L-1NH4Cl��Һ��NH4Cl���塢��̪��Һ��pH��ֽ������ˮ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
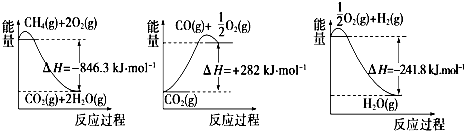
| ������� | H2CO3 | NH3•H2O |
| Ka1 | 4.30��10-7 | 1.77��10-5 |
| Ka2 | 5.61��10-11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
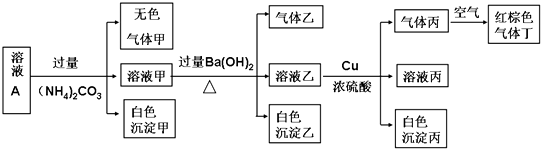
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com