
一种太阳能电池的工作原理示意图如下所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
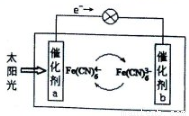
A.K+移向催化剂b B.催化剂a表面发生反应:Fe(CN)64――e-=Fe(CN)63-
C.Fe(CN)63-在催化剂b表面被氧化 D.电解质溶液中Fe(CN)63-和Fe(CN)64-浓度基本保持不变
科目:高中化学 来源:2013-2014山东省临沂市高三5月二模理综化学试卷(解析版) 题型:实验题
(18分)废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备CoxOy,的工艺流程简图如下:
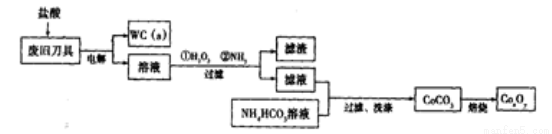
(1)电解时废旧刀具作阳极,不锈钢作阴极,盐酸的作用是______。
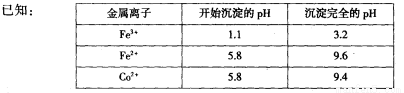
(2)通人氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择pH最大范围是____________。
(3)实验测得NH4HCO3溶液显碱性,制备CoCO3时,选用的加料方式是_______(填代号),原因是_______。
a.将滤液与NH4HCO3溶液同时加入到反应容器中
b.将滤液缓慢加入到盛有NH4HCO3溶液的反应容器中
c.将NH4HCO3溶液缓慢加入到盛有滤液的反应容器中
写出生成CoCO3的离子方程式______________________________________。
(4)实验中获得的若洗涤不充分,在焙烧时会产生污染性气体,该污染性气体的成分为_______________(填化学式)。
(5)实验室用下列装置制取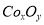 ,并测定其化学式。
,并测定其化学式。
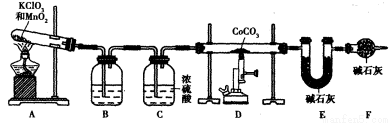
①装置A制得的中含有少量Cl2,则装置B中所盛放的试剂为______(填代号)。
a.NaHCO3溶液 b.NaOH溶液 c.KMnO4溶液 d.饱和NaCI溶液
②在CoCO3完全转化为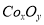 后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成物
后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成物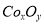 的化学式为____________。
的化学式为____________。
③若缺少装置F,则导致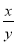 的值______(填“偏大”、“偏小”或“无影响”)。
的值______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省东营市高三第二次模拟理科综合化学试卷(解析版) 题型:选择题
化学与人类生产、生活、社会可持续发展密切相关。下列有关说法错误的是
A.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
B.在汽车排气管上加装“催化转化器”是为了减少有害气体的排放
C.硬铝属于合金材料,瓷器属于硅酸盐制品
D.食醋可去除水垢,NH4Cl溶液可去除铁锈
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省蚌埠市高三第三次教学质量检查理综化学试卷(解析版) 题型:选择题
用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4 (g) + 2N2 (g) + 6H2 (g)  Si3N4(s) + 12HCl (g) ?H < 0
Si3N4(s) + 12HCl (g) ?H < 0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是 ( )
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | N2 的物质的量 | H2的转化率 |
C | H2的浓度 | 平衡常数K |
D | 压强 | N2 的转化率 |
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省皖南八校高三第三次联考理综化学试卷(解析版) 题型:填空题
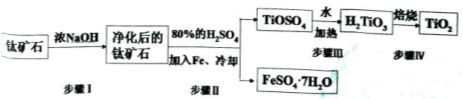
(15分).钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。工业上常以钛矿石(主要成分为FeTiO3(钛酸亚铁),并含FeO、A12O3、 SiO2等杂质)为主要原料经过以下流程制得TiO2,并获得副产品FeSO4·7H2O.
请回答下列问题:
(l)步骤I的目的是
(2)写出步骤Ⅱ中FeTiO3与H2SO4反应的化学方程式 。
(3)步骤II中经过 、 、过滤、洗涤等操作可以得到FeSO4·7H2O.晶体,还可以利用酸化的FeSO4溶液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水).该反应的离子方程式为
(4)请结合化学用语用化学平衡理论解释步骤III中将TiOSO4转化为H2TiO3的原理:
(5)为测定步骤II后溶液中TiOSO4的含量,首先取待测钛液10 mL加水稀释至100 mL,再加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,以KSCN溶液为指示剂,用0.1000 mol·L-1 NH4Fe(SO4)2溶液滴定至终点,再重复2次,测得平均值为30.00mL。
①该滴定达到终点时的现象
②待测钛液中TiOSO4的物质的量浓度是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省淮南市下学期期末考试高一化学试卷(解析版) 题型:实验题
现有一试管NO2,某同学设计如下表实验,以尽可能多地使NO2被水吸收。
⑴请完成下表:
实验步骤 | 实验现象 | 解释(用化学方程式表示) | |
① | 将充满NO2的倒立在盛有水的水槽中,拨去橡皮塞,轻轻晃动试管。 | 试管内气体由 色逐渐变为无色,液面上升至试管高度的 (离管口)处。 |
|
② |
|
|
|
③ | 重复步骤②的操作数次,直至液体充满整个试管。 | 试管内充满无色液体。 | 总反应方程式:
|
⑵在下面方框中画出此实验的装置简图。

查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省淮南市下学期期末考试高一化学试卷(解析版) 题型:选择题
某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式是( )
A.HXO3 B. H2XO3 C. H2XO4 D. H3XO4
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省高二(下)期末考试化学试卷(解析版) 题型:填空题
(15分)阿明洛芬(G)属于苯丙酸类抗炎药,镇痛效果优于布洛芬。下图是阿明洛芬的一条合成路线。
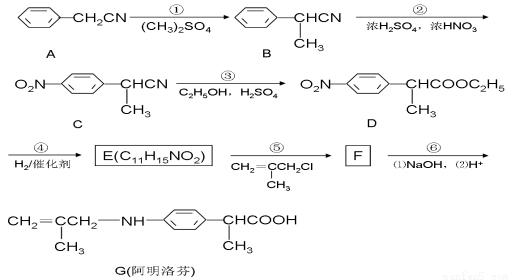
(1)E的结构简式为 ;②的反应类型: 。
(2)D中含氧官能团的名称为 、 。
(3)反应③可以看成是两步反应的总反应,第一步是氰基(-CN)的完全水解反应生成羧基(-COOH),请写出第二步反应的化学方程式: 。
(4)任意写出两种符合下列条件的E的同分异构体的结构简式 、 。
①能与FeCl3溶液发生显色反应 ②能发生水解反应,但不能发生银镜反应
③苯环上的取代基只有2种,且苯环上的核磁共振氢谱有两个吸收峰
(5)下列有关阿明洛芬(G)的说法正确的是( )
A.分子式为C13H17NO2 B.属于氨基酸
C.能与盐酸反应生成盐 D.能发生取代、加聚、氧化、还原反应
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:实验题
(12分)根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:
2NO+2CO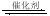 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g |
Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
Ⅱ |
|
|
|
| 120 |
Ⅲ | 探究温度对尾气转化速率的影响 | 360 |
|
| 80 |
【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
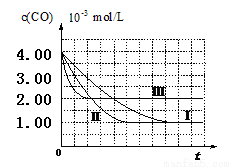
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________
(填“增大”、“减小”、“无影响”);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com