
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)已知:① CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g)![]() CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式 。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如下左图:
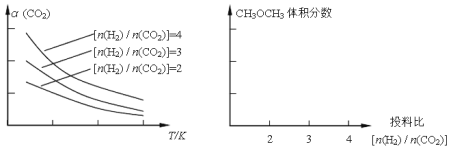
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
②某温度下,将2.0 mol CO2(g)和6.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是 。
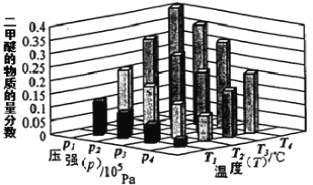
A. P3>P2,T3>T2 B. P1>P3,T1>T3
C. P2>P4,T4>T2 D. P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的平衡常数的表达式为:
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下CO的平衡转化率为 。
【答案】
(1)CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) ΔH=-162 kJ·mol-1
CH4(g)+2H2O(g) ΔH=-162 kJ·mol-1
(2)①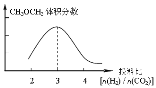 ;② B D
;② B D
(3)K=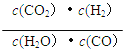 ;放热;75%
;放热;75%
【解析】
试题分析:(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g)△H=-41kJmol-1,
H2(g)+CO2(g)△H=-41kJmol-1,
②C(s)+2H2(g)![]() CH4(g)△H=-73kJmol-1,
CH4(g)△H=-73kJmol-1,
③2CO(g)![]() C(s)+CO2(g)△H=-171kJmol-1,根据盖斯定律,③-①×2+②得:
C(s)+CO2(g)△H=-171kJmol-1,根据盖斯定律,③-①×2+②得:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H=-162 kJmol-1,
CH4(g)+2H2O(g)△H=-162 kJmol-1,
故答案为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H=-162 kJmol-1;
CH4(g)+2H2O(g)△H=-162 kJmol-1;
(2)①CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]的增大而增大,当体积比是3的时候,甲醚的体积分数最大,由极限法可知,投料比无限增大,虽然二氧化碳的转化率增大,但混合气体总体积无限大,而二甲醚的体积无限接近二氧化碳的一半,二甲醚的体积分数减小,故二甲醚的体积分数与投料比的关系为: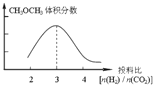 ,故答案为:
,故答案为: ;
;
②由图3可知,温度一定时,平衡时二甲醚的物质的量分数:P1>P2>P3>P4,而该反应正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,二甲醚的物质的量分数增大,故压强:P1>P2>P3>P4;由图1可知,投料比[n(H2)/n(CO2)]一定时,温度越高,平衡时二氧化碳的转化率越高,说明升高温度,平衡向逆反应方向移动,二甲醚的物质的量分数减小,而压强一定时,平衡时二甲醚的物质的量分数:T1<T2<T3<T4,故温度:T1>T2>T3>T4,故选:BD;
(3)反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数表达式K=
H2(g)+CO2(g)的平衡常数表达式K=![]() ;由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向,逆反应方向移动,则正反应为放热反应;设CO的浓度变化量为xmol/L,则:
;由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向,逆反应方向移动,则正反应为放热反应;设CO的浓度变化量为xmol/L,则:
CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
开始(mol/L):0.02 0.02 0 0
转化(mol/L): x x x x
平衡(mol/L):0.02-x 0.02-x x x
则![]() =9,解得x=0.015,故CO的转化率为
=9,解得x=0.015,故CO的转化率为![]() ×100%=75%,故答案为:
×100%=75%,故答案为:![]() ;放热;75%。
;放热;75%。


科目:高中化学 来源: 题型:
【题目】某溶液中只含有Ba2+ Mg2+ Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
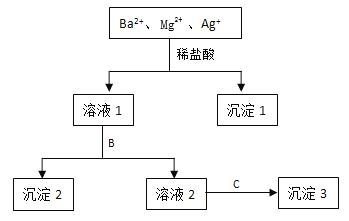
(1)沉淀1的化学式为 ,生成该沉淀的离子方程式为 。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为 。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 高压钠灯常用于道路的照明 B. 饱和石灰水用来制漂白粉
C. 硅晶体用作半导体材料 D. 金属镁常用来制造信号弹和焰火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是
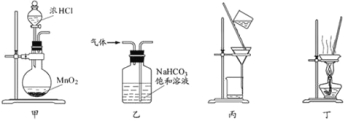
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干NaHCO3溶液制NaHCO3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
A.K+、MnO4﹣、Na+、Cl﹣
B.K+、Na+、NO3﹣、CO32﹣
C.Na+、H+、NO3﹣、SO42﹣
D.Fe3+、Na+、Cl﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m (n>2,m≤10)的实验流程如下:

已知:盐基度=![]() ×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
(1)实验加入硫酸的作用是____________,取样分析Fe2+浓度,其目的是___________。
(2)用pH试纸测定溶液pH的操作方法为____________,若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数____________(填“偏高”、“偏低”、“无影响”)
(3)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2][Fe2(OH)n(SO4)3-n/2]m,则水解反应的化学方程式为____________.
(4)产品盐基度的测定方法:
Ⅰ称取m g固体试样,置于400mL聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.
Ⅱ室温下放置10min,再加入10mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀.
Ⅲ加入5滴酚酞指示剂,立即用物质的量浓度为c molL-1的氢氧化钠标准液滴定至终点,消耗体积为VmL.
Ⅳ向聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0mL.
①达到滴定终点的现象为____________。
②已知试样中Fe3+的质量分数为a,则该试样的盐基度的计算表达式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于废弃塑料制品的处理方法中,最为恰当的是( )
A.将废弃物切成碎片,混在垃圾中填埋于土壤中
B.将废弃物焚烧
C.将废弃物倾倒在海洋中
D.将废弃物应用化学方法加工成防水涂料或汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于麻黄碱的说法错误的是( )
A.麻黄碱是国际奥委会严格禁止使用的兴奋剂
B.麻黄碱是从中药中提取的天然药物
C.麻黄碱能使人兴奋,运动员服用后能超水平发挥
D.麻黄碱有镇静催眠的效果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4molL-1的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A.0.21mol B.0.25mol C.0.3mol D.0.35mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com