
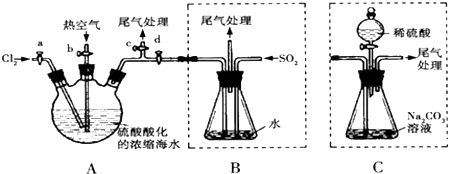
分析 A中海水用硫酸酸化,通入热空气和氯气,发生氧化还原反应生成溴,空气将溴吹出,通入二氧化硫,发生Br2+SO2+H2O═2HBr+H2SO4,富集后再通入氯气,生成溴,可用氢氧化钠溶液吸收尾气,
(1)氯气为黄绿色气体,反应完毕应剩余氯气;
(2)溴易挥发,鼓入空气可将溴排出;
(3)溴与二氧化硫发生氧化还原反应;
(4)溴、氯气和二氧化硫都有毒,可用碱液吸收;
(5)溴和碳酸钠反应生成了溴化钠和溴酸钠,结合质量守恒配平方程式;
(6)采用C装置,步骤少,减少了二氧化硫的污染.
解答 解:A中海水用硫酸酸化,通入热空气和氯气,发生氧化还原反应生成溴,空气将溴吹出,通入二氧化硫,发生Br2+SO2+H2O═2HBr+H2SO4,富集后再通入氯气,生成溴,可用氢氧化钠溶液吸收尾气,
(1)氯气为黄绿色气体,反应完毕应剩余氯气,容器A中液面上有黄绿色气体出现,故答案为:容器A中液面上有黄绿色气体出现;
(2)溴易挥发,升高温度促进其挥发,所以通入热空气的目的是吹出Br2,故答案为:吹出反应中生成的Br2;
(3)溴与二氧化硫发生氧化还原反应,反应的化学方程式为Br2+SO2+H2O═2HBr+H2SO4,故答案为:Br2+SO2+H2O═2HBr+H2SO4;
(4)氯气不可能完全反应,氯气和溴离子反应生成溴单质,未反应的二氧化硫、氯气和溴都有毒,不能直接排空,且这几种物质都能和碱反应,所以用碱液吸收,
故答案为:C;
(5)溴和碳酸钠反应生成了溴化钠和溴酸钠,反应的方程式为3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,故答案为:3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑;
(6)采用C装置,步骤少,减少了二氧化硫的污染,故答案为:无污染,操作简便.
点评 本题结合海水提取溴的过程,为高频考点,侧重于学生的分析、实验能力的考查,题目注重考查了实验基本操作、实验方案的评价、氧化还原反应方程式的书写,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 将Na块投入水中,产生气体:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 0.1 mol•L-1亚硫酸氢钠溶液的pH约为3:HSO3-+H2O═SO32-+H3O+ | |
| D. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 定容后,塞好瓶塞,反复倒转、摇匀 | |
| C. | 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X是形成化合物类最多,它一气态氧化物能产生温室效应 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z和Y形成一化合物Z2Y2为淡黄色粉末,可作为呼吸面具里氧气来源 |
| V | V的单质是淡黄色固体,是黑火药一主要成分 |
| W | 日常生活中应用最广泛的金属之一,且W有几种不同价态的氧化物,其中一种有磁性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com