
关于下列各图的说法中,正确的是
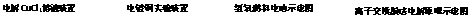
A.①中与电源负极相连的电极附近能产生使湿润淀粉KI试纸变蓝的气体
B.②中待镀铁制品应该与电源的正极相连接
C.③中的b极是电子流出的极,发生氧化反应
D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等。有人设计了图中的工艺流程,利用常用的酸、碱 和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
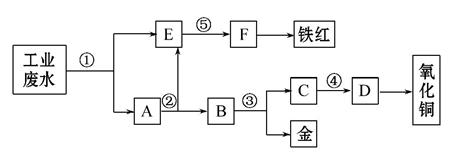
填写下面空白:
(1)图中标号处需加入的相应物质分别是
①________、②________、③________、④________、⑤________;
(2)写出①处的离子方程式:________________________ _______________;
_______________;
写出③处的化学方程式:__________________________________________;
(3)铁红的化学式为________;分别写出铁红和氧化铜在工业上的一种主要用途
 :铁红________;氧化铜________。
:铁红________;氧化铜________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1mol X跟a mol Y在体积可变的密闭容器中发生如下反应:X(g)+a Y(g)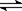 b Z(g) 反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是:( )
b Z(g) 反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是:( )
A.a=1,b=1 B.a=2,b=1 C.a=2,b=3 D.a=3,b=3
查看答案和解析>>
科目:高中化学 来源: 题型:
I、恒温下,将a mol N2与b mol H2的混合气体通入一个固体容积的密闭容器中,发生如下反应:N2(g)+3H2(g)  2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,计算 a= 。
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量 。。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),
n( 始):n(平)= 。
(4)原混合气体中,a:b= 。
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)= 。
(6)平衡混合气体中,n(N2):n(H2):n(NH3)= 。
II、若向体积不变的密闭容器中充入2 mol N2和6 mol H2,一定条件下发生反应:
N2(g)+ 3 H2(g) 2 NH3(g),平衡时混合气共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
2 NH3(g),平衡时混合气共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
(1)若a=0,b=0,则c= .
(2)若a=0.7,b=2.1,则:
① c= .
②这时反应向 进行,因为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验原理或实验操作正确的是
A.用干燥pH试纸测定某新制氯水的pH
B.用图1装置除去乙烷中混有的乙烯
C.用图2装置能验证HCl气体在水中的溶解性
D.用25mL碱式滴定管量取20.00mL KMnO4溶液
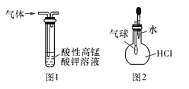
查看答案和解析>>
科目:高中化学 来源: 题型:
Q、W、X、Y、Z为五种原子序数依次增大的短周期元素。已知:
①Q原子的核外电子数等于电子层数,且与W组成的一种化合物是沼气的主要成分;
②元素X的最高价氧化物的水化物和其气态氢化物能够反应,生成离子化合物甲;
③W与Y组成的化合物乙,是机动车排出的大气污染物之一,也是造成“雾霾”天气的有害物质之一;
④Y与Z能形成电子总数为30和38的两种离子化合物,分别为丙和丁
(1)W在周期表中的位置是_______________;
丁的电子式是 ____ _______。
(2)WY2与Z2Y2反应的化学方程式是__________________。
(3)甲在水溶液中的水解方程式为_______________
(4)写出一种实验室制取XQ3的方法____________(用化学方程式表示)
(5)标准状况下22.4L X的气态氢化物,与0.5L 1mol/L的X最高价氧化物的水化物反应,所得溶液中离子浓度由大到小的顺序是__________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
含a个氧原子的硫酸中:
(1)H2SO4分子的个数为________;
(2)H2SO4的物质的量为________;
(3)H2SO4的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
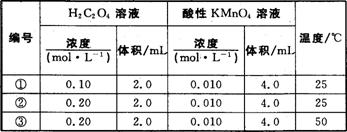
(1)该反应的离子方程式为 ,
(2)探究温度对化学反应速率影响的实验编号是 (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 .
(3)实验①测得KMn04溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMn04)= mol·L-1·min-1。
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(Mn04-)~t的变化曲线示意图。
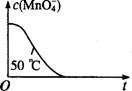
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com