
【题目】下列离子方程式中,正确的是
A.碳酸氢铵溶液中加入足量的浓氢氧化钠溶液并加热:NH![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
B.铜与稀硝酸的反应:Cu+4H++2NO![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
C.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO![]() =BaSO4↓+H2O
=BaSO4↓+H2O
D.过量二氧化硫与氢氧化钠溶液反应:SO2+OH-=HSO![]()
科目:高中化学 来源: 题型:
【题目】下列有关实验的图示及分析均正确的是( )
选项 | 实验目的 | 实验图示 | 实验分析 |
A | 催化裂解正戊烷并收集产物 |
| 正戊烷裂解为分子较小的烷烃和烯烃 |
B | 石蜡油的分解并检验产物 |
| 石蜡油分解的 产物含有不饱和烃 |
C | 制取并收集乙炔 |
| 用饱和食盐水代替纯水,可达到降低反应速率的目的 |
D | 实验室制硝基苯 |
| 反应完全后,可用仪器a、b蒸馏提纯产品 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究碳酸氢钠的热稳定性,并利用其产物验证过氧化钠与二氧化碳的反应,按以下装置图进行实验,按要求填空。
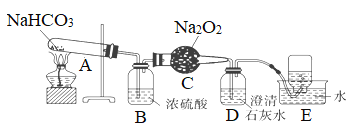
(1)A中反应的化学方程式为________。
(2)B中浓硫酸的作用是____。
(3)C中发生反应的化学方程式为____,每反应1molNa2O2转移______mol电子。
(4)D中现象是_____,反应的离子方程式是_____________________。
(5)E中收集的气体主要是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列9种微粒:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。按要求完成以下各题:
。按要求完成以下各题:
(1)![]() 、
、![]() 分别是氢元素的一种______,它们互为______。
分别是氢元素的一种______,它们互为______。
(2)互为同素异形体的微粒是______。
(3)![]() 的中子数为______,核外电子数为______。
的中子数为______,核外电子数为______。
(4)形成上述9种微粒的核素有______种、元素有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是目前人类使用量最大的金属,它能形成多种化合物。
(1)取5.6g生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24L(标准状况),最主要的原因是___;所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因:___。
(2)ZnFe2O4是一种新型纳米材料,可将工业废气中的CO转化为CO2,则ZnFe2O4中Fe元素的化合价为___。ZnFe2O4和CO在1200℃发生反应:6ZnFe2O4+2CO![]() 6ZnO+2CO2+aM(其中a为化合物M的化学计量数),则M的化学式为___,反应中ZnFe2O4作___剂。
6ZnO+2CO2+aM(其中a为化合物M的化学计量数),则M的化学式为___,反应中ZnFe2O4作___剂。
(3)LiFePO4是锂离子电池材料之一。以FePO4、Li2CO3和单质碳为原料在高温下制备LiFePO4,该反应还生成一种可然性气体,则反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是 ( )
①CS2为V形的极性分子 ②![]() 的立体构型为平面三角形③SF6中有6对完全相同的成键电子对 ④SiF4和
的立体构型为平面三角形③SF6中有6对完全相同的成键电子对 ④SiF4和![]() 的中心原子均采用sp3杂化
的中心原子均采用sp3杂化
A.①③B.②④C.①②D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
![]() 工业利用冶铜炉渣
工业利用冶铜炉渣![]() 含Fe2O3、FeO、SiO2、Al2O3等
含Fe2O3、FeO、SiO2、Al2O3等![]() 制Fe2O3的生产流程示意图如下:
制Fe2O3的生产流程示意图如下:
炉渣![]() 滤液
滤液![]() 沉淀
沉淀![]() 氧化铁
氧化铁
经“足量的NaOH溶液”处理后,铝元素的存在形态为 ______ ![]() 填序号
填序号![]() .
.
a.Al b.Al(OH)3 c.Al3+ d.AlO2-
![]() 要证明某溶液不含Fe3+但可能含有Fe2+,最佳的实验操作顺序是 ______
要证明某溶液不含Fe3+但可能含有Fe2+,最佳的实验操作顺序是 ______ ![]() 填序号
填序号![]() .
.
①加入少量氯水②加入足量KMnO4溶液③加入少量NH4SCN溶液
a. ①③ b.③② c. ③① d. ①②③
(3)25℃时,23gC2H5OH在血液中被氧气完全氧化放出668kJ热量,该反应的热化学方程式为 ______ .
(4)X、Y、Z、Q、R是原子序数依次增大的短周期主族元素,X、Q同主族,Z+与Y2-具有相同的电子层结构,Q 的单质是一种重要的半导体材料,R的单质在常温下呈气态.
①X、Y、Z三种元素的原子半径从大到小的顺序是 ______ ![]() 用元素符号表示
用元素符号表示![]() ,写出含有X、Y、Z三种元素且水溶液显碱性的物质化学式 ______ .
,写出含有X、Y、Z三种元素且水溶液显碱性的物质化学式 ______ .
![]() 下列选项一定能说明R的非金属性比X强的是 ______
下列选项一定能说明R的非金属性比X强的是 ______ ![]() 填序号
填序号![]() .
.
a.原子的半径:r(R)>r(X)
b.原子的最外层电子数:n(R)>n(X)
c.热稳定性:R的气态氢化物>X的气态氢化物
d.酸性:R的最高价氧化物对应的水化物>X的最高价氧化物对应的水化物
③R在周期表的位置是 ______ R和Q形成的化合物在潮湿的空气中冒白色烟雾,该反应的化学方程式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.少量的碳酸氢钠溶液与澄清石灰水混合:2![]() +2OH-+Ca2+=CaCO3↓+
+2OH-+Ca2+=CaCO3↓+![]() +2H2O
+2H2O
B.过量的碳酸氢钠溶液与澄清石灰水混合:![]() +OH-+Ca2+=CaCO3↓+H2O
+OH-+Ca2+=CaCO3↓+H2O
C.碳酸氢钠溶液与少量的盐酸溶液混合:![]() +H+=CO2↑+H2O
+H+=CO2↑+H2O
D.碳酸钠溶液与过量的盐酸溶液混合:Na2CO3+2H+=2Na++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U、V、W、X、Y、Z 是原子序数依次增大的六种常见元素。Y 的单质在 W2 中 燃烧的产物可使品红溶液褪色 。 Z 和 W元素形成的化合物 Z3W4 具有磁性 。 U 的单质在 W2中燃烧可生成 UW 和 UW2 两种气体 。 X 的单质是一种金属,与冷水反应缓慢、与沸水反应迅速。
请回答下列问题:
(l)V的单质的分子式为____________ 。
(2)Z元素在周期表中的位置是____________。
(3)U、V、W形成的10电子氢化物中,沸点最高的是_________(填化学式,下同);V、W 的简单氢化物分子结合H+能力较强的是_________。
(4)X和Y元素形成的化合物的电子式为___________。
(5)Y的最高价氧化物对应的水化物与X单质反应的离子方程式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com