
| 物质 | 熔点 | 沸点 | 水溶性 | 相对分子质量 |
| 乙二醇 | -12.9℃ | 197.3℃ | 溶于水、醇 | 62 |
| 甲醇 | -97℃ | 64.7℃ | 与水互溶 | 32 |
| 草酸二甲酯 | 54℃ | 163.5℃ | 微熔于冷水,溶于醇和醚 | 118 |
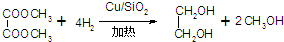
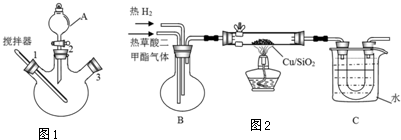
分析 (1)A的名称是分液漏斗;混合时将混合物进入冷水中;
(2)B装置中草酸二甲酯气体和氢气能充分混合;草酸二甲酯的熔点是54℃,低于该温度时草酸二甲酯变为固态;
(3)乙二醇的沸点是197.3℃、甲醇的沸点是64.7℃、草酸二甲酯的沸点是163.5℃,要制得较纯净的乙二醇,温度应该在其沸点左右;
(4)n(H2)=$\frac{16g}{2g/mol}$=8mol,n(H3COOCCOOCH3)=$\frac{59g}{118g/mol}$=0.5mol,根据方程式知,0.5mol草酸二甲酯完全反应需要氢气2mol,所以氢气过量,如果草酸二甲酯完全反应生成乙二醇为0.5mol,其质量=0.5mol×62g/mol=31g,其产率=$\frac{实际产量}{理论产量}×100%$;
(5)醇羟基能和钠反应生成醇钠和氢气,可以利用乙二醇和钠反应生成氢气确定乙二醇是二元醇.
解答 解:(1)A的名称是分液漏斗;混合时将混合物沿杯壁慢慢注入装有冷水的烧杯(或容器)中,并不断搅拌,故答案为:分液漏斗;将混合物沿杯壁慢慢注入装有冷水的烧杯(或容器)中,并不断搅拌;
(2)B装置中草酸二甲酯气体和氢气能充分混合,更有利于反应向右进行;草酸二甲酯的熔点是54℃,低于该温度时草酸二甲酯变为固态,导致堵塞导管而产生安全事故,
故答案为:使草酸二甲酯和氢气混合均匀;温度低于55℃,未反应的草酸二甲酯会凝结堵塞导管;
(3)乙二醇的沸点是197.3℃、甲醇的沸点是64.7℃、草酸二甲酯的沸点是163.5℃,要制得较纯净的乙二醇,温度应该在其沸点左右,为197.3℃(197℃左右即可),
古答案为:197.3℃(197℃左右即可);
(4)n(H2)=$\frac{16g}{2g/mol}$=8mol,n(H3COOCCOOCH3)=$\frac{59g}{118g/mol}$=0.5mol,根据方程式知,0.5mol草酸二甲酯完全反应需要氢气2mol,所以氢气过量,如果草酸二甲酯完全反应生成乙二醇为0.5mol,其质量=0.5mol×62g/mol=31g,其产率=$\frac{实际产量}{理论产量}×100%$=$\frac{12.4g}{31g}$×100%=40%,
故答案为:40%;
(5)醇羟基能和钠反应生成醇钠和氢气,可以利用乙二醇和钠反应生成氢气确定乙二醇是二元醇,其检验方法为取62g乙二醇,加入足量金属钠充分反应,收集并测量生成的氢气的质量是2g(或其他合理答案,乙二醇与氢气的量符合正确比例即可),
故答案为:取62g乙二醇,加入足量金属钠充分反应,收集并测量生成的氢气的质量是2g(或其他合理答案,乙二醇与氢气的量符合正确比例即可).
点评 本题考查物质制备,为高频考点,涉及官能团个数的检验、方程式计算、物质分离和提纯等知识点,把握化学反应原理、物质性质差异性是解本题关键,难点是实验方案设计(5)题,侧重考查学生知识综合运用及实验操作能力,题目难度中等.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:解答题
 电子天平 b.
电子天平 b. 坩埚 c.
坩埚 c. 干燥器 d.
干燥器 d. 酒精喷灯
酒精喷灯| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
| 5.200g | 7.900g | 6.900g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
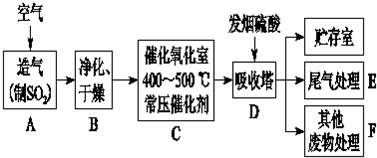
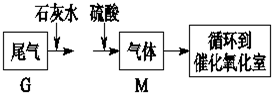
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.5 mol•L-1•s-1 | ||
| C. | v(C)=1.8 mol•L-1•min-1 | D. | v(D)=1 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 优等品 | 一等品 | 合格品 | |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热、冷却、称量,重复两次即是恒重操作 | |
| B. | 瓷坩埚加热后冷却时,必须放在干燥器中 | |
| C. | 加热晶体时先用小火,后渐改为用大火加热 | |
| D. | 加热时如晶体爆溅出坩埚,应再加一些晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| B. | 高锰酸钾溶液、酒精、过氧化钠都能杀菌消毒,消毒原理相同,都利用了强氧化性 | |
| C. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 | |
| D. | PM2.5是指大气中直径接近2.5微米的颗粒物,入肺影响健康,这种颗粒物分散空气中形成胶体,它具有丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤液化、气化,有利于提高燃料的燃烧效率,减少污染物的排放 | |
| B. | 侯氏制碱法,向饱和NaCl溶液中先通入CO2再通入氨气制取纯碱 | |
| C. | 电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等 | |
| D. | 工业生产硫酸时,建立高烟囱可以降低地面SO2的浓度,减少空气污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com